Teoría / La fórmula Seger
En el tema anterior se introdujo un esquema para clasificar el vidriado que consistía en describirlos a partir de los óxidos que lo forman. A continuación, se describirá con más detalle dicha idea, que es lo que se conoce como fórmula Seger o fórmula unitaria, pero antes de entrar de lleno en el tema, se introducirán algunos conceptos de base.
La tabla periódica y el enlace químico
Ya vimos en el tema anterior algo sobre la tabla periódica de los elementos, pero ahora vamos a describirla con más detalle, ya que la TP es el punto de partida de toda la química, es el instrumento que ordena todos los elementos químicos y relaciona unos con otros. Conociendo un poco la tabla periódica, va a resultar mucho más fácil recordar y relacionar las propiedades de las sustancias que aparecen en el estudio de la tecnología cerámica.
En la siguiente imagen se representa la tabla periódica. Es una imagen bastante grande, que puede ampliarse seleccionando "ver imagen" (o algo parecido) al pulsar el botón derecho del ratón sobre ella, para ver bien algunos números pequeños. Para seguir las explicaciones recomiendo abrir una nueva pestaña con la tabla ya que en la explicación se alternará continuamente entre el texto y la tabla. También puede consultarse cualquier otra TP en Internet, que hay muchas y muy variadas.
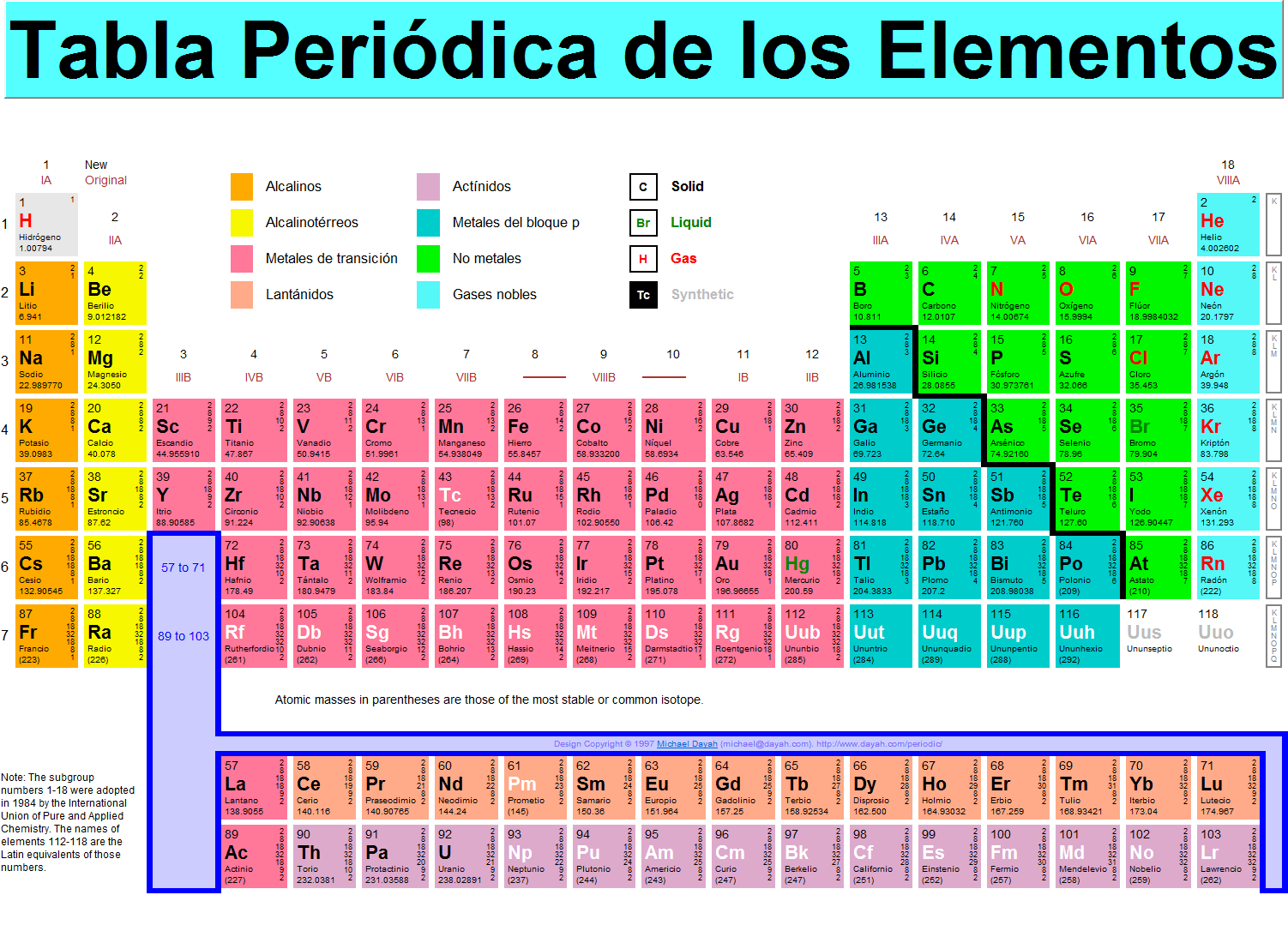
En la tabla hay filas y columnas
La tabla periódica se organiza en una serie de filas y columnas: 18 columnas y 7 filas, más las series de los lantánidos y los actínidos, que se representan en dos filas bajo la tabla principal. Los elementos colocados en la misma columna tienen, en general, un comportamiento químico similar, y las propiedades químicas de los elementos varían progresivamente según nos desplazamos a lo largo de cada fila. Vemos que algunas partes de la tabla se han señalado con colores, por ejemplo, la primera columna, exceptuando el hidrógeno, contiene los elementos alcalinos.
Esos números que aparecen junto a los símbolos de los elementos...
En cada casilla, junto al símbolo del elemento, aparecen tres tipos de números: un número entero a la izquierda, sobre el símbolo del elemento, una ristra de números desde la esquina superior derecha hacia abajo, y un número decimal bajo el nombre del elemento. Por ejemplo, para el hierro, los tres números son, respectivamente: 26; 2, 8, 14, 2; 55·8457. El primer número se llama "número atómico" y nos da la cantidad de protones que hay en el núcleo atómico. Este número es exclusivo de cada átomo, por ejemplo, cualquier átomo que contenga 26 protones en el núcleo, es un átomo de hierro. La ristra de números a la derecha representa la distribución electrónica del átomo, sobre ello hay una explicación algo más detallada abajo, ahora baste observar que la suma de esos números coincide con el número atómico, lo cual es consecuencia de que en el átomo hay la misma cantidad de electrones que de protones -excepto si el átomo es un ion, ya lo veremos-. En el hierro 2+8+14+2=26. El tercer número se llama "peso atómico" o "masa atómica" y expresa lo que pesa el átomo (en ciertas unidades), lo cual, se corresponde aproximadamente con la suma de protones más neutrones...también se amplía más abajo.
La estructura del átomo
Hemos mencionado que los protones se encuentran en el núcleo atómico. Los átomos, aunque son inimaginablemente pequeños, tienen una estructura interna que se compone de un reducido núcleo, formado por protones y neutrones, y una zona exterior con los electrones. Casi toda la masa del átomo se encuentra en el núcleo, ya que protones y neutrones tienen la misma masa, y la masa de cada uno es unas dos mil veces mayor que la del electrón. Por otra parte, el átomo es como un enorme espacio vacío con un punto en el centro, el espacio vacío sería la estructura electrónica y el punto sería el núcleo. Es tradicional representar el átomo como un sistema solar en el que núcleo atómico sería el sol y los electrones serían los planetas, sin embargo, solo es una idealización pues la descripción más aproximada del átomo es puramente matemática y choca con el sentido común. De las tres partículas atómicas, el protón tiene carga eléctrica positiva y el electrón carga eléctrica negativa e idéntica en valor absoluto a la del protón. El neutrón, como indica su nombre, no tiene carga eléctrica. Al ser iguales las cargas de protón y electrón y también los respectivos números de cada uno en el átomo, los átomos son neutros eléctricamente, sin embargo, veremos que algunos átomos pueden tener más o menos electrones de los que le corresponden. En tal caso, el átomo no es neutro y se denomina ion. Si tiene exceso de electrones, será negativo (anión) y si tiene menos de la cuenta, positivo (catión).
Los neutrones y la fuerza nuclear
En principio, extraña que todos los protones estén apelotonados en el núcleo atómico, ya que al tener cargas de igual signo se repelen y tienden a separarse, sin embargo, hay una fuerza, llamada "interacción nuclear fuerte", que mantiene ligadas las partículas constituyentes del núcleo atómico. Ya vimos que cada especie atómica tiene siempre el mismo número de protones, pero es posible que una misma clase de átomo no tenga siempre el mismo número de neutrones en el núcleo, lo cual da lugar a los diferentes "isótopos" atómicos, es decir, átomos de la misma especie pero con diferente número de neutrones y, por tanto, diferente masa atómica. Precisamente, el tercero de los números que aparecen en cada casilla de la tabla, que indica el peso atómico del elemento, se calcula haciendo una media ponderada entre los diferentes isótopos de cada elemento. Por ejemplo, si miramos el peso atómico del carbono (12,0107), nos indica que casi todos los isótopos de carbono tienen 6 neutrones, pero la parte decimal indica también que debe haber isótopos de peso superior. Un ejemplo conocido es el carbono 14, el isótopo de carbono con 6 protones y 8 neutrones que se utiliza para datar determinadas sustancias de gran antigüedad.
Electrones
Decíamos que la ristra de números a la derecha representa la distribución de los electrones, y esta disposición se rige por las leyes de la mecánica cuántica en función de una serie de reglas. Según esta ordenación primero se disponen dos electrones, después ocho, ocho más, luego dieciocho,...Esta distribución electrónica es la que da forma a la tabla periódica: una serie de dos elementos en la primera fila de la tabla, dos series de ocho en las dos filas siguientes, una serie de dieciocho elementos en la cuarta fila,etc. En realidad, de cada elemento químico solo son interesantes los últimos electrones, es decir, el número colocado más abajo en cada ristra. Este número es el que establece las propiedades químicas de cada elemento porque es el número de electrones que participa en las reacciones químicas, el resto, todos los demás, están muy ligados al núcleo atómico y no participan en las reacciones químicas. Por ejemplo, los elementos alcalinos tienen un solo electrón en su última capa (este modelo electrónico suele denominarse "modelo de capas" y cada número da la cantidad de electrónes en cada capa, así que el último número correspondería a la última capa), los alcalinostérreos dos, y así sucesivamante.
Voy a remarcar estas últimas líneas, por si han pasado desapercibidas: toda la química depende solo del último número de la ristra. Ese número, normalmente, coincide con la valencia del átomo.
La regla del octeto
Si nos fijamos en la última columna de la tabla periódica, vemos que todos los elementos que la componen tienen ocho electrones en la última capa. Estos elementos son los gases nobles y son los menos reactivos de la tabla periódica. Son tan poco reactivos que el helio se descubrió primero en el Sol antes de saber de su existencia en la tierra (un elemento poco reactivo no participa en las reacciones químicas y, por tanto, no deja huella). El caso es que la baja reactividad de estos elementos dió lugar a una primera teoría sobre el enlace químico, la regla del octeto, según la cual los átomos buscan una disposición con ocho electrones un su última capa, es decir, si no tienen ocho electrones en la última capa se combinan con otros átomos mediante intercambio de electrones para alcanzar una distribución electrónica estable con ocho electrones en la última capa. Por ejemplo, el Cl tiene siete electrones en la última capa y el Na solo uno, por tanto hacen buena pareja. El Na le cede su electrón al Cl y ambos iones permanecen unidos mediante atracción electrostática. La sustancia que se forma a partir de la unión, NaCl, es la sal común.
Enlace químico
Al explicar la regla del octeto hemos mencionado el ejemplo de la sal común, que es una sustancia iónica porque el enlace se establece mediante la cesión de electrones entre los átomos con la consiguiente formación de iones. Otra posibilidad de enlace es el covalente, en este caso los electrones no se ceden sino que se comparten. Por ejemplo, la mayor parte de las moléculas que forman la atmósfera terrestre constituyen enlaces covalentes. Así, el oxígeno suele encontrarse como O2 y en este enlace cada átomo de oxígeno comparte una pareja de sus electrones con el otro para alcanzar la configuración estable de ocho electrones. Otra posibilidad es el enlace metálico, cuya complejidad no admite la sencilla explicación de la regla del octeto sino que requiere la teoría cuántica de bandas. En el caso de los metales, ciertos electrones se ceden a una nube electrónica que es común a todos los átomos del metal y que da lugar a propiedades como la conductividad eléctrica. Los compuestos iónicos y los metálicos no forman moléculas individuales sino grandes bloques de partículas que se ordenan en redes cristalinas. En los compuestos covalentes puede pasar esto mismo, por ejemplo, en el diamante o también puede ocurrir que se formen sustancias a partir de enlaces moleculares como, por ejemplo, el agua.
Resumen
Como resumen de todo lo visto en esta sección voy a destacar dos cosas. En primer lugar, que los electrones más externos de cada átomo, los de su última capa, son los responsables del comportamiento químico del átomo. Como ejercicio, teniendo en cuenta la regla del octeto, intenta escribir la fórmula de los óxidos, es decir, la combinación de un elemento con oxígeno, de los elementos químicos de interés cerámico que se enumeraron en el tema anterior. Teniendo en cuenta que los átomos que se encuentran en una misma columna de la tabla tienen el mismo comportamiento químico, una vez que conocemos la forma del óxido de uno de ellos, sabemos que los demás de una misma columna tendrán la misma fórmula, sustituyendo los correspondientes símbolos químicos.
En segundo lugar, destacar el concepto de peso atómico, es decir, lo que pesa cada átomo. Esta magnitud será importante cuando aprendamos qué es la fórmula Seger o, mejor dicho, el dato que necesitaremos para nuestros cálculos será el peso molecular.

Peso atómico, peso molecular, y el mol
Vamos a aclarar el concepto de peso molecular que acabamos de introducir en el último párrafo de la sección anterior. Es un concepto muy sencillo que aprenderemos a partir de un ejemplo: ¿Cuál es el peso molecular del agua? El ejercicio consiste en calcular lo que pesa una molécula de agua, cuya fórmula es bien conocida, H2O. La fórmula química del agua nos dice que está compuesta por dos átomos de H y uno de O, luego su peso molecular será dos veces el peso atómico del H más una vez el peso atómico del O. Si buscamos estos valores en la tabla periódica, encontramos que:
Peso molecular(H2O) = 2·Peso atómico(H) + Peso atómico(O) = 2·1,008 + 15,999 = 18,015 uma (la expresión "uma" significa unidades de masa atómica).
Es importante observar que hemos aproximado a tres decimales. En general, adoptaremos ese acuerdo con los pesos moleculares cuando empecemos con el cálculo de la fórmula Seger: utilizar tres números decimales. Se deja como ejercicio calcular el peso molecular de la sílice y de la alúmina y, después, utilizando los valores obtenidos, calcular el peso molecular de la caolinita.
Dentro de poco veremos que los pesos moleculares de las diferentes materias primas que se usan en cerámica, se utilizan bastante en los cálculos. No es necesario calcular cada vez dichos pesos moleculares a partir de los pesos atómicos de los átomos que componen la molécula, sino que suelen buscarse directamente en una tabla de materias primas.
Receta vs fórmula Seger
Para introducir los conceptos de fórmula y receta vamos a ver una captuta de pantalla de uno de los vidriados de la base de datos de esta web:

La receta se compone de seis materias primas: bisilicato de Pb, ortosa (feldespato K), caliza, caolín, óxido de Sn y carbonato de Cu. En una receta siempre vamos a encontrar sustancias que, de un modo u otro podemos conseguir, más sus respectivos pesos. Convencionalmente, los pesos se dan como porcentajes para que sea más sencillo preparar la cantidad que se quiera, pero son magnitudes que se pueden pesar en la balanza. Es decir, la receta es lo que necesitamos para preparar un vidriado, nos dice los ingredientes que necesitamos y sus respectivas cantidades. Por otra parte, vemos que la fórmula consiste en una serie de óxidos, ordenados de alguna extraña manera, precedidos por unos números.
La receta representa el vidriado en crudo. Una vez que pesamos y mezclamos los ingredientes de la receta,se aplican sobre el cacharro y va al horno. En el horno, durante la cocción, ocurren una serie de transformaciones químicas que, principalmente, consisten en la descomposición de las materias primas, con volatilización de algunos productos y la fusión del resto. A las elevadas temperaturas a las que transcurre la cocción de los vidriados, todo lo que queda tras la descomposición, volatilización, fusión y enfriamiento final, está en forma de óxidos, ya que el oxígeno es muy reactivo y al elevarse la temperatura todo se combina con él, es decir, se oxida. Así que la fórmula Seger expresa la composición del vidriado cocido como una suma de óxidos. Como se puede suponer, los números que aparecen en la fórmula, de alguna manera, deben expresar las cantidades en las que se encuentran presentes los diferentes óxidos. Sobre estos números hablaremos en la próxima sección.
Alguno se estará preguntando por qué no aparecen todas las materias primas en la receta, y el carbonato de Cu y el óxido de Sn solo los encontramos en un comentario aparte. Pues bien, al calcular la fórmula Seger que corresponde a una receta, a veces hay ingredientes se no se tienen en cuenta. Estos ingredientes son los que modifican el aspecto visual del vidriado que, en este ejemplo, serían el óxido de Sn que, como ya sabemos, es un opacificante, y el carbonato de Cu, que sirve para colorear el vidriado. Así pues, la fórmula Seger suele calcularse solo a partir de una serie de ingredientes que constituyen la base del vidriado. Por ejemplo, el carbonato de Cu podría cambiarse por otro óxido colorante que, añadido a la misma base, nos daría un vidriado muy parecido pero de un color diferente.
El concepto de mol
Los números que aparecen en la fórmula Seger se llaman moles y tienen mucho que ver con las fórmulas químicas. Por ejemplo, la conocida fórmula de la caolinita, 2SiO2·Al2O3·2H2O, la hemos interpretado hasta ahora como que una molécula de caolinita se compone de dos moléculas de sílice, una de alúmina y dos de agua. Pero veremos que hay otra interpretación, según la cual un mol de caolinita está formado por dos moles de sílice, un mol de alúmina y dos moles de agua. Esto, aunque parece lo mismo...no es lo mismo. La diferencia es una cuestión de cantidad. Lo que es una molécula se entiende sin demasiados problemas. Los átomos tienen afinidad unos por otros y se agrupan en moléculas, ya dijimos que los únicos átomos que no se combinan con otros son los de gases nobles. Todos los demás forman parte de moléculas o macromoléculas.
Entonces se entiende, más o menos, lo que es una molécula de agua, ¿pero alguien ha visto una?. Para verla necesitaríamos un microscopio, pero no un microscopio cualquiera sino el que más aumenta de todos: el microscopio de efecto túnel. Es tan pequeña la molécula de agua que es imposible obtenerlas de una en una, y lo mismo para cualquier otra molécula, todas ellas están fuera de nuestro alcance, aunque podamos comprender lo que son. La cuestión es que, en química, es importante saber cuántos átomos o moléculas tenemos de cada cosa, porque estos o aquellas reaccionan entre sí en proporciones enteras, es decir, si pongo dos de estos y tres de los otros, se forma un compuesto determinado, pero si pongo tres de estos y dos de los otros, entonces se forma otro distinto. Y lo mismo ocurre con los vidriados. Necesito aprender a contar moléculas.
Para resolver este problema se inventó el mol. Una definición de mol dice que un mol de algo son 6,022·1023 partículas de ese algo. Por ejemplo, un mol de agua son 6,022·1023 moléculas de agua, o el número de Avogadro de moléculas de agua. Es un número enorme. Lo suficientemente grande como para que ya podamos verlo. De hecho, lo importante del mol es que sabemos su peso. Un mol de agua pesa lo mismo que el peso molecular del agua, es decir, 18.015g. Es importante darse cuenta de la unidad, que ya no es el uma sino el gramo. El número de Avogadro de moléculas de agua pesan 18.015g. Por si alguien no se ha dado cuenta, hemos resuelto el problema problema que teníamos entre manos: ya podemos contar moléculas o, en realidad, moles, que son cantidades ingentes de moléculas.
Vamos a tratar de asentar el concepto con un experimento imaginario. Como ceramista que soy puedo conseguir sílice, alúmina y agua, que son los óxidos que componen la caolinita. Si quiero fabricar caolinita a partir de tales materias primas, tendría que poner dos moléculas de agua y otras dos de sílice por cada molécula de alúmina para obtener el caolín. En realidad, sería poco práctico fabricar la caolinita de molécula en molécula. ¡Hagámoslo de mol en mol! Si mezclo dos moles de agua y dos de sílice por cada mol de alúmina, obtendré un mol de caolín. Pero ya sabemos obtener moles de cosas, solo necesitamos pesar los respectivos pesos moleculares en gramos. Algunos párrafos más arriba se pedía calcular los pesos moleculares de sílice, alúmina y caolinita. Si no lo hiciste (remember, remenber I will see you in september), ahí van las cuentas:
Peso molecular(sílice, SiO2) = Peso atómico(Si) + 2·Peso atómico(O) = 28,086 + 2·15,999 = 60,084 uma
Peso molecular(alúmina, Al2O3) = 2·Peso atómico(Al) + 3·Peso atómico(O) = 2·26,981 + 3·15,999 = 101,959 uma
El peso molecular del agua ya lo calculé, 18,015 uma. Entonces, repito, si mezclo dos moles de sílice con dos de agua y uno de alúmina, obtendré un mol de caolinita. Es decir, pongo en el mortero 2·60,084g de sílice más 2·18,015g de agua más 101,959g de alúmina y obtendré 258,157g de caolinita, o sea, un mol de caolinita. Este número también me dice que: Peso molecular(caolinita) = 258,157 uma.
Este es un experimento imaginario porque la caolinita no puede fabricarse así, sino que es un proceso muy largo que necesita muchos cientos de años para completarse, pero resulta que para hacer vidriados cerámicos el proceso sí funciona. Primero se mezclan los ingredientes que se han calculado con un procedimiento similar al descrito, después se aplica al cacharro, se mete al horno...y al salir se ha formado el vidriado.
Si volvemos a fijarnos en la fórmula Seger que aparecía en la imagen del apartado anterior, ya podemos decir, al menos, qué significa cada dato que aparece en ella:
0,690 PbO__0,208 Al2O3__2,004 SiO2
0,116 K2O
0,194 CaO
El vidriado que describe la fórmula contiene cinco óxidos, y los números que hay delante de cada óxido son sus respectivos moles. En las fórmulas químicas "normales", es decir, de sustancias que se encuentran en la naturaleza, los números que aparecen junto a los óxidos son casi siempre números enteros. Esto es porque las sustancias naturales, como por ejemplo, una especie mineral como la caolinita, son cristalinas y sus partículas constituyentes se asocian siempre en las mismas proporciones en todo el cristal, lo cual da origen a una fórmula en la que aparecen números enteros sencillos. Sin embargo, en los vidrios, como en los vidriados cerámicos, no existe el orden propio de las redes cristalinas y, por eso, los números que aparecen en la fórmula Seger, que es lo más parecido a la fórmula química que describe el vidriado, no son enteros ni sencillos en general.
Hablando de fórmulas, hay que decir que esta costumbre de expresar la composición de las cosas en forma de óxidos es algo específicamente cerámico, y es consecuencia de que en cerámica todo pasa por las altas temperaturas del horno y se oxida pero, en realidad, en química o geología no siguen la misma práctica, y la expresión de la fórmula tiene más que ver con la composición cristalina del mineral en cuestión que con los óxidos que resultan tras la cocción. Por ejemplo, en mineralogía, la caolinita suele escribirse como Al2Si2O5(OH)4. También hay que decir que la fórmula Seger es un invento utilizado solo entre ceramistas y ni los químicos ni los físicos o los geólogos han oído hablar de ella.
Para acabar este apartado, repetiremos los conceptos más importantes sobre el mol:
Primero - Un mol de algo es muchas veces ese algo, tantas veces como el número de Avogadro (y cuando digo algo hay que entender que tiene sentido para cosas muy pequeñas, como los átomos o las moléculas, ya que, por ejemplo, un mol de granos de arroz pesarían más que toda la Tierra)
Segundo - Un mol de algo pesa, en gramos, la magnitud de su peso molecular. Por ejemplo, un mol alúmina, pesa 101,959 gramos.
Tercero - El concepto de mol es tan importante porque nos permite pasar de lo microscópico a lo macroscópico. Nos permite, por ejemplo, contar moléculas, aunque sea en cantidades múltiplo del número de Avogadro, pero eso no importa porque son esas cantidades las que somos capaces de medir. Téngase en cuenta que un mol de agua, es decir, 6,022·1023 moléculas de agua, pesan solo 18,015 gramos.

La fórmula Seger
Para describir la fórmula Seger, voy a volver al siguiente ejemplo:
0,690 PbO__0,208 Al2O3__2,004 SiO2
0,116 K2O
0,194 CaO
Ya mencionamos que esta fórmula muestra cinco óxidos y la proporción molar entre ellos, pero no sabemos más. Lo más característico de la fórmula Seger es que especifica un orden muy concreto para escribir los óxidos. Estos se disponen siempre en tres columnas que, químicamente, corresponden a los óxidos básicos, en la primera columna, los neutros o anfóteros, en la columna central, y los ácidos, a la derecha. Es muy común que, como en el ejemplo de arriba, las columnas del centro y derecha solo contengan un óxido cada una, la alúmina y la sílice, respectivamente. Una forma sencilla de identificar a qué columna pertenece un óxido concreto es fijarse en la relación de átomos de óxigeno. Así, los óxidos tipo X2O y XO como, por ejemplo, Na2O o CaO, son básicos (se colocan en la primera columna); los de tipo X2O3, son neutros (segunda columna); y el resto, por ejemplo los XO2, son ácidos y se colocan en la tercera columna. Después de analizar unas cuantas fórmulas Seger y algo de experiencia con las materias primas, nos deremos cuenta de que en la primera columna se colocan los fundentes y en las otras dos, la sílice y la alúmina. Y si la fórmula Seger es más compleja e incluye impurezas u opacificantes y colorantes, veremos que los óxidos colorantes suelen tener carácter fundente y pertenecen a la primera columna, excepto algunos más refractarios que son anfóteros, y que los opacificantes son ácidos.
Otra característica importante de la fórmula Seger es que los coeficientes de los óxidos de la primera columna, los fundentes o básicos, deben sumar uno. Por ello, en muchos libros en vez de denominarla fórmula Seger, prefieren el término fórmula unitaria. Con esta convención, la fórmula Seger facilita su lectura ya que, de un vistazo, podemos conocer la proporción de sílice y alúmina respecto a los fundentes. Así, en el ejemplo de arriba, es fácil ver que hay, aproximadamente, el doble de sílice que de fundentes y diez veces más sílice que alúmina, lo cual, unido al tipo de fundentes que se utilizan, apunta a que podría tratarse de un vidriado de baja temperatura, transparente y brillante. Aunque, como veremos, hay que ser bastante cautelosos a la hora de interpretar una fórmula Seger, pues las excepciones son comunes en cerámica y la única seguridad se obtendrá al hacer una muestra del vidriado.
Sobre la posición de los óxidos en la fórmula, solo hay una excepción a lo que ya se ha descrito. El óxido de boro, B2O3, por el carácter anfótero de su fórmula debería colocarse en la columna central, por su comportamiento como activo fundente podría colocarse en la primera columna, junto a los fundentes, y por su comportamiento como formador de vidrio, en el mismo sentido que la sílice, podría colocarse junto a esta en la tercera columna. La bibliografía cerámica está dividida entre colocarlo en la segunda columna o en la tercera. Nosotros seguiremos la norma de colocar el boro en la segunda columna, bajo la alúmina.
Ahora tenemos algunas nociones sobre los elementos que aparecen en la fórmula, pero la única manera de entender la relación de los distintos óxidos entre sí para ser capaz de aventurar el tipo de vidriado que puede esperarse de una fórmula concreta o componer vidriados a partir de su fórmulación, es una amplia experiencia. Un buen ejercicio para empezar, a falta de elaborar vidriados propios o ajenos si no tenemos esa posibilidad, es fijarse en los resultados de la base de datos de vidriados e intentar analizar las fórmulas y las características que se especifican, en relación con el resultado.
Podemos entender la fórmula Seger como la fórmula química, aunque los químicos no hayan oído hablar de ella, de ese extraño mineral que es el vidriado, que en vez de formarse en las entrañas de la Tierra se ha parido in vitro, en el horno cerámico. Igual que en un mineral, se especifica la relación entre sus distintos componentes, pero a diferencia de casi todos los minerales, que son cristalinos, dicha relación no es sencilla, no está dada por números enteros.
Cuentas
El cálculo necesario para convertir fórmulas a recetas, y viceversa, es bastante sencillo pero puede llegar a ser muy farragoso, por lo que se hace imprescindible la calculadora y, en caso de estar interesado en una investigación de cierta amplitud sobre los vidriados en base a la fórmula Seger, también sería muy útil algún programa informático que haga las cuentas.
Para describir el proceso, volveremos sobre un ejemplo conocido:
0,690 PbO__0,208 Al2O3__2,004 SiO2
0,116 K2O
0,194 CaO
Calcularemos una receta para esta fórmula, y remarco una receta, en lugar de la receta, porque se pueden calcular distintas recetas para una misma fórmula. En realidad, este es uno de los usos más comunes de la fórmula Seger, precisamente el cálculo de una receta diferente a partir de una conocida en la que nos interese cambiar alguno de los componentes.
Vamos a describir paso a paso, el cálculo de una receta a partir de su fórmula Seger:
Primero: Se escogen las materias primas, anotando la fórmula de cada una y su peso molecular. Para ello se suele utilizar una tabla de materias primas, que suelen incluirse en la mayoría de libros cerámicos que tratan el cálculo de vidriados. De cualquier forma, como estamos aprendiendo, nos viene bien calcular los pesos moleculares, e incluso elaborar por nuestra cuenta una tabla de materias primas según las vayamos utilizando.
Para elaborar esta receta podríamos escoger las siguientes materias primas:
-Bisilicato de plomo, que es una frita de fórmula 1 PbO _ 0,06 Al2O3 _ 1,64 SiO2, y peso molecular 327,854 uma.
-Feldespato potásico, cuya fórmula teórica es K2O·Al2O3·6SiO2, y el peso molecular 556,658 uma.
-Caliza o carbonato de calcio, de fórmula CO3Ca y peso molecular 100,086 uma.
-Caolín, de fórmula 2SiO2·Al2O3·2H2O y peso molecular 258,157 uma.
-Cuarzo, de fórmula SiO2 y peso molecular 60,084 uma.
Segundo: Se calculan los moles que serán necesarios de cada materia prima a partir de los moles de los óxidos que aparecen en la fórmula Seger. Si sigo el orden en que aparecen en la fórmula, necesito en primer lugar 0,69 moles de PbO. Como la materia prima elegida para introducir el PbO es el bisilicato de Pb, debo averiguar cuántos moles de bisilicato necesito poner en la receta para obtener los 0,69 moles de PbO. Como cada mol de bisilicato me da un mol de PbO, vemos que para los 0,69 moles de PbO tenemos que poner 0,69 moles de bisilicato. A continuación, razonando de la misma forma sobre el K2O y el CaO, vemos que necesito 0,116 moles de ortosa y 0,194 de caliza. Lo siguiente es la alúmina, aunque en este caso debemos tener en cuenta que ya hemos introducido cantidades de alúmina con el feldespato y con el bisilicato, por tanto, primero debemos calcular cuánto hemos puesto ya y cuánto falta por poner. Hemos puesto, 0,69 x 0,06 = 0,041 moles (los moles de bisilicato por los moles de alúmina que contiene el bisilicato) con el bisilicato y 0,116 x 1 = 0,116 con la ortosa, es decir, 0,157 moles en total, luego faltan por poner 0,208 - 0,157 = 0,051 moles que vamos a introducir como caolín. Finalmente queda cuadrar la sílice. Como antes, veremos en primer lugar cuánto hemos puesto ya: del bisilicato 0,69 x 1,64 = 1,132 moles; del feldespato 0,116 x 6 = 0,696; y del caolín 0,051 x 2 = 0,102. En total son 1,930 moles, luego faltan 0,074 moles que introducimos como cuarzo.
Siempre se acaba esta fase de los cálculos en el mismo orden: en penúltimo lugar se introduce la alúmina y siempre a partir de alguna arcilla (arcilla de bola, arcilla de Alcañiz, caolín, etc...) que muchas veces es caolín por ser la arcilla que menos impurezas contiene y, finalmente, se calcula la cantidad de cuarzo que falta.
Tercero: Hasta ahora estamos trabajando con moles. Los números de la fórmula Seger son moles y acabamos de calcular, a partir de ellos, los moles que necesitamos de cada materia prima. Sin embargo, en una receta no aparecen moles sino pesos. La receta nos indica las cantidades que debemos pesar en la balanza. Entonces, el paso que nos queda es convertir los moles en pesos. Este es un paso sencillo, todo lo complicado ya está hecho. Sabiendo que un mol pesa en gramos lo que sea su peso molecular, para hacer la cuenta que falta, basta multiplicar los moles de las materias primas por sus respectivos pesos moleculares:
Bisilicato de plomo: 0,69 x 327,854 = 226,219g
Feldespato potásico: 0,116 x 556,658 = 64,572g
Caliza: 0,194 x 100,086 = 19,417g
Caolín: 0,051 x 258,157 = 13,166g
Cuarzo: 0,074 x 60,084 = 4,446g
Las mágnitudes calculadas se expresan en gramos, hay que recordarlo: un mol es el peso molecular en gramos, luego al calcular el peso de los moles multiplicando nº de moles por peso molecular, el resultado son gramos.
Cuarto: Prácticamente, la cuenta está acabada. Los números que hemos calculado nos dan la proporción en peso de las diferentes materias primas y, si lo pesamos y mezclamos los ingredientes, obtendremos el vidriado. Sin embargo, la cantidad obtenida es completamente arbitraria. Si sumamos las cinco materias primas, sale:
226,219 + 64,572 + 19,417 + 13,166 + 4,446 = 327,82 gramos
Este número no es muy cómodo para sacar múltiplos de él y poder preparar las cantidades que necesitemos, por eso, normalmente la receta se da en tanto por ciento, que es un número más sencillo para utilizarlo como base de cálculo para cualquier otra cantidad. Para obtener el tanto por ciento, %, simplemente dividimos cada cantidad entre la suma que acabamos de obtener y el resultado se multiplica por cien. Así:
226,219 ÷ 327,820 = 0,690 > 69,0% bisilicato Pb
64,572 ÷ 327,820 = 0,197 > 19,7% ortosa
19,417 ÷ 327,820 = 0,059 > 5,9% caliza
13,166 ÷ 327,820 = 0,040 > 4% caolín
4,446 ÷ 327,820 = 0,014 > 1,4% cuarzo
Estas cuatro etapas nos permiten calcular una receta a partir de su fórmula Seger:
1 - Elegimos las materias primas y apuntamos sus fórmulas químicas y sus pesos moleculares.
2 - Calculamos los moles necesarios de cada materia prima a partir de los moles de los óxidos presentes en la receta.
3 - Pasamos los moles calculados en la etapa anterior a pesos multiplicando por el peso molecular.
4 - Finalmente, convertimos el resultado a tanto por ciento.
Todavía falta aprender el cálculo inverso, es decir, dada una receta, calcular su fórmula Seger. En este caso la fórmula sí es única, es decir, a cada receta le corresponde una única fórmula Seger. Este cálculo es más sencillo que el anterior, ya que no necesitamos elegir materias primas, que era la etapa más compleja del cálculo anterior porque requería cierto conocimiento de las materias primas, aparte de los meros cálculos. Ahora partimos de pesos y materias primas y debemos calcular los correspondientes óxidos y sus moles. De nuevo, utilizaremos el mismo ejemplo para mostrar el método:
Primero: Se escriben las fórmulas y pesos moleculares de las diferentes materias primas que aparecen en la receta. Como vamos a partir de la receta que acabamos de calcular, basta mirar un poco más arriba para obtener estos datos iniciales. Recomiendo que se vayan escribiendo las cuentas en un papel.
La receta es: 69,0% bisilicato Pb
19,7% ortosa
5,9% caliza
4% caolín
1,4% cuarzo
Segundo: Se escriben los óxidos de la fórmula en la misma posición que les corresponde en la fórmula pero todavía sin sus respectivos coeficientes molares, que se calcularan posteriormente. Si has apuntado en un papel las fórmulas de las materias primas, solo tienes que buscar los distintos óxidos que aparecen y colocarlos en el orden correcto, que es el siguiente:
PbO__ Al2O3__ SiO2
K2O
CaO
Tercero: Lo siguiente es calcular los moles de las materias primas que corresponden a los pesos que aparecen en la receta. Siempre es posible convertir entre nº de moles y pesos utilizando el peso molecular para hacer el cambio. Si queremos convertir moles en pesos, como hicimos en el caso anterior, multiplicamos por el peso molecular y, si queremos convertir pesos a moles, entonces dividimos entre el peso molecular. La cuenta es la siguiente:
Bisilicato de plomo: 69,0 ÷ 327,854 = 0,210 moles
Feldespato potásico: 19,7 ÷ 556,658 = 0,035 moles
Caliza: 5,9 ÷ 100,086 = 0,059 moles
Caolín: 4,0 ÷ 258,157 = 0,015 moles
Cuarzo: 1,4 ÷ 60,084 = 0,023 moles
Cuarto: Ahora podemos colocar ya los moles en la fórmula. Para ello, debemos poner delante de cada óxido en la fórmula las contribuciones hechas por cada materia prima. Si empezamos con el óxido de Pb, veremos que todo viene del bisilicato. Como acabamos de calcular que necesitamos 0,210 moles de bisilicato y la fórmula del bisilicato nos indica que por cada mol de bisilicato también estamos poniendo un mol de PbO, el coeficiente del PbO será 0,210 x 1 = 0,210. Para el K2O y el CaO los cálculos son igual de sencillos y, con estos tres coeficientes, la fórmula queda:
0,210 PbO__ Al2O3__ SiO2
0,035 K2O
0,059 CaO
El cálculo para la alúmina es ligeramente más complicado porque esta vez contribuyen tres materias primas: el bisilicato, la ortosa y el caolín. Los 0,210 moles de bisilicato contribuyen con 0,06 moles de alúmina por mol, como puede verse en la fórmula del bisilicato, luego son 0,210 x 0,06 = 0,013 moles. A estos hay que sumar la contribución del feldespato, 0,035 x 1 = 0,035, y la del caolín, 0,015 x 1 = 0,015. En total, tendremos 0,013 + 0,035 + 0,015 = 0,063 moles de alúmina. Si ahora hacemos un cálculo similar para la sílice obtenemos: 0,210 x 1,64 = 0,344 moles del bisilicato; 0,035 x 6 = 0,210 moles de la ortosa; y 0,015 x 2 = 0,030 moles del caolín. En total son 0,344 + 0,210 + 0,030 + 0,023 = 0,607 moles de sílice. Colocando los nuevos datos en la fórmula:
0,210 PbO__ 0,063 Al2O3__ 0,607 SiO2
0,035 K2O
0,059 CaO
Este resultado casi es la fórmula Seger pero todavía falta hacer algo para acabar. Igual que en el último paso de fórmula a receta debimos convertir los extraños pesos que salieron en un porcentaje, ahora debemos convertir esos extraños números de moles en algo más fácil de interpretar. Para ello, la costumbre es que la primera columna, la de los óxidos, sume uno. Podemos conseguirlo si dividimos todos los coeficientes de la fórmula entre la suma de los coeficientes de la primera columna. ¡Ojo!, lo importante es mantener la proporción entre los coeficientes entre sí, lo cual puede hacerse dividiendo todos ellos entre un mismo número. Es decir, vamos a escribir una fórmula que mantiene la misma proporción molar entre los óxidos pero en la que la suma de los coeficientes de la primera columna es la unidad.
La suma de la primera columna es 0,210 + 0,035 + 0,059 = 0,304. Si divido todo entre 0,304 la fórmula queda:
0,691 PbO__ 0,207 Al2O3__ 1,999 SiO2
0,115 K2O
0,194 CaO
Comparando la fórmula original con el resultado obtenido, vemos que las cifras no coinciden exactamente. Es normal que haya errores en la última cifra decimal, aunque también es posible que se haya cometido algún error en los cálculos...¿te sale a ti el mismo resultado?

1886: Seger desarrolla los conos y la fórmula del vidriado
Voy a finalizar esta primera parte sobre vidriados reproduciendo el primer capítulo del libro de Green mencionado en la bibliografía. En este capítulo se reproduce la investigación que llevó a Seger al establecimiento de los conos para medir la tempertura y, al mismo tiempo, a inventar su fórmula para expresar la composición de un vidriado que, entonces, le sirvió para expresar la composición de los conos.
Habían transcurrido unos cien años desde que se pusiesen los cimientos de la química y completado los avances necesarios para que ceramistas y fabricantes de vidrio fuesen capaces de aplicar tales descubrimientos sistemáticamente en sus propios campos. Ambas industrias estaban a la sazón bajo presión para mejorar la calidad de sus productos; mejores vidrios se demandaban para la producción de instrumental científico y los talleres de cerámica europeos se desenvolvían en un entorno en constante competencia.
La industria del vidrio fue de la mano del famoso trío compuesto por el profesor Abbé, el Dr. Schott y el Dr. Roderick Zeiss, quienes cooperaban en la puesta a punto de una fábrica para de producción de vidrio óptico en Jena en 1884. Sus experimentos habían comenzado en 1876 por iniciativa del profesor Abbé y consistieron principalmente en la investigación de los efectos de la introducción de nuevos óxidos en la manufactura del vidrio. Al comienzo de los experimentos, solo se había estudiado con cierto detalle el efecto de cinco óxidos en las propiedades ópticas (silicio, potasio, sodio, plomo y calcio). En 1881, no menos de otros 28 óxidos metálicos se habían probado en pequeñas muestras, de modo que, cuando comenzó la producción comercial en 1884, la firma era capaz de ofrecer una considerable oferta de vidrios con propiedades específicas para un amplio rango de actividades científicas y otros usos.
El nombre de Zeiss y la ciudad de Jena, en Checoslovaquia, no necesitan presentación para ningún fotógrafo, pero el trabajo de Abbé y Schott, junto con Winkelmann que se unió a ellos más tarde, debería ser igualmente familiar para los estudiosos de la literatura sobre vidriados cerámicos.
El crédito por ser el primero en aplicar los nuevos conocimientos a la cerámica se le debe dar, en cambio, a Hermann Seger (1839-1893), quien durante su corta vida, de solo 54 años, publicó más de 170 artículos y tratados.
Seger se dio a conocer por su trabajo en el desarrollo del horno continuo Hoffman para ladrillos, que estuvo disponible desde 1857, y en 1869 fue designado al laboratorio y oficina editorial de la German Pottery and Brick Journal, editora de Transactions of the German Society for the Manufacture of Bricks, Clayware, Lime and Cement. Cuando el editor que había murió en 1871, Seger fue designado para el cargo y durante los años siguientes publicó, entre otros, sus conocidos trabajo sobre el cuarteado de los vidriados y el análisis racional de las arcillas.
Posteriormente, Seger fundó el Tonindustrie Zeitung (Clay Industries Newspaper, primer número del 2 de diciembre de 1876), con un laboratorio de análisis anexo, y aceptó, uno o dos años después, la dirección de un nuevo laboratorio en la Royal Porcelain Works de Berlín.
La publicación que ha hecho conocido el nombre de Seger entre los ceramistas vio la luz en 1886 –de ahí la fecha que titula el capítulo. En este artículo, “Standard Cones for the Measurement of Temperatures in the Kilns of the Ceramic Industry”, él propone el uso de una serie de vidriados cerámicos definidos, moldeados en polvo en forma triangular cónica (tetraédrica) como guía sobre la temperatura en el interior del horno. Este mecanismo tan sencillo (los conos Seger, como se conocen desde hace muchos años) es muy eficaz en su medida, según su curvatura, no solamente de la temperatura, sino también de los cambios provocados por el calor a las pastas cerámicas y vidriados que hay en el horno en un momento concreto de la cocción.
El artículo comienza con un resumen sobre los métodos disponibles para la medición de la temperatura junto a una exposición de sus limitaciones. Los métodos incluyen el juicio visual a partir del color en el horno (que era el método usual a la sazón), termómetros de gas o mercurio, expansión o contracción diferencial de metales o arcillas o el punto de fusión de los metales. Concluye el estudio con algunos instrumentos que han sido utilizados pero sin mucho éxito, aparte del pirómetro eléctrico original Siemens que era caro, con medidas de temperaturas con amplios márgenes y con frecuente necesidad de calibrar por la pérdida de resistencia.
Seger entonces consideró el empleo de conos prefundidos de vidrio, pero se vio obligado a abandonar la idea debido a la imposibilidad de obtener composiciones puras no contaminadas por sustancias disueltas en el crisol en el que se realizaba la fusión, o alteradas por la pérdida de álcalis volatilizados desde la superficie durante la fusión. También se dio cuenta de que muchos vidrios desvitrifican a la baja velocidad de calentamiento de los hornos cerámicos, formando cristales que no se funden durante el primer periodo de reblandecimiento, de manera que la etapa temprana de la fusión –que resulta crítica en estos conos– se alarga. En consecuencia, Seger decidió utilizar para la fabricación de los conos los ingredientes que se usan para la elaboración de los vidriados de porcelana (feldespato, caliza, cuarzo y caolín) porque, por una parte, se encuentran naturalmente en composiciones relativamente exactas y, por otra parte, porque no contienen sustancias volátiles.
Para sus experimentos Seger seleccionó las materias primas más puras disponibles, un feldespato de Roerstrand, caolín de Zettlitz, cuarzo de Noruega y como caliza, mármol de Carrara y, a partir de estas, realizó conos de 6 cm de altura.
Las pruebas experimentales comenzaron con mezclas de feldespato y caliza. La mayoría de los ceramistas actuales supondrían, ya que el óxido de calcio es un fundente, que cualquier adición de este al feldespato, ya sea como mármol o caliza, debería facilitar la fusión de este, pero, cuando Seger coció estos primeros conos, junto a alguno hecho de feldespato puro, obtuvo un resultado distinto. Ninguna de las muestras fundía antes que el feldespato, y las de mayor contenido en CaO resultaron ser las menos fusibles.
Similarmente, encontró que adiciones de caolín o cuarzo también elevaban el punto de fusión del feldespato y no fue hasta que comenzó a añadir caliza y caolín a la vez cuando logró mezclas con un punto de fusión más bajo. Los resultados negativos son, sin embargo, útiles como punto de partida de cualquier investigación y, antes de pasar a ver cómo consiguió Seger sus primeros éxitos, vamos a tratar de entender cómo interpretó estos resultados negativos.
Análisis y fórmulas de las materias primas de Seger
En su artículo sobre Standard Cones, Seger presenta una tabla con el análisis porcentual de las materias primas utilizadas en sus pruebas con el fin de mostrar su grado de pureza. Dichas tablas representan los pesos porcentuales de los diferentes óxidos presentes según los resultados obtenidos en el laboratorio, a partir de los métodos de análisis disponibles en la época.
Si dichos pesos porcentuales se dividen entre los pesos moleculares de los óxidos (que representan los pesos relativos de las diferentes moléculas entre sí), ocultamos las diferencias provenientes de los distintos pesos moleculares y revelamos las proporciones numéricas en las cuales se presentan las moléculas. Por ejemplo, el feldespato puro podría presentar la siguiente composición porcentual:
Óxidos Pesos porcentuales
K2O 17
Al2O3 18
SiO2 65
Si dividimos entre los respectivos pesos moleculares, obtenemos los siguientes resultados:
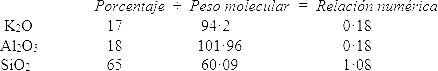
Así que por cada 0,18 moléculas de óxido de potasio en el feldespato hay también 0,18 moléculas de alúmina y 1,08 moléculas de sílice. Dividiendo entre 0,18 simplificamos la relación a números enteros:
K2O Al2O3 SiO2
1 : 1 : 6
Que es, como puede comprobarse, la fórmula química aceptada para el feldespato.
Al llevar a cabo el mismo procedimiento para el resto de materias primas que Seger utilizó, llegamos a las siguientes fórmulas:
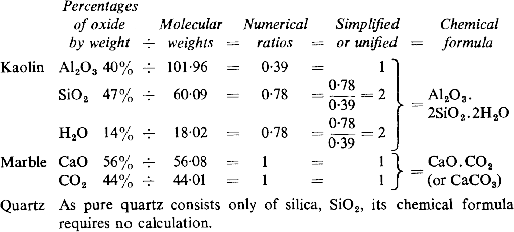
Pesos equivalentes
Antes de poder ir más allá, Seger necesitaba encontrar los pesos equivalentes de los diferentes minerales que utilizaba, para estar en disposición no solo de saber cuánto de cada uno se incluye en las mezclas sino también conocer las relaciones moleculares que los diferentes minerales pueden producir.
Nosotros ya sabemos que, por ejemplo, una molécula de sílice es 60,09 (su peso molecular) veces más pesada que un átomo de hidrógeno en la escala comparativa de pesos atómicos y moleculares, y que una molécula de alúmina es 101,96 veces más pesada. Esto nos dice que las moléculas de alúmina son algo más pesadas que las de sílice y, por lo tanto, si quisiéramos obtener igual número de ambas para una reacción química deberíamos pesar un poco más de alúmina que de sílice. La proporción exacta de alúmina respecto a la sílice la podemos obtener dividiendo 101,96 entre 60,09. Estos números que nos dan la cantidad que debemos pesar de cada óxido para mantener la proporción correcta entre ellos son los “equivalentes”.
El peso equivalente del cuarzo (sílice pura) es 60,09. Las cantidades equivalentes para los otros minerales pueden hallarse fácilmente si sumamos los pesos moleculares de los distintos óxidos que forman parte de él:
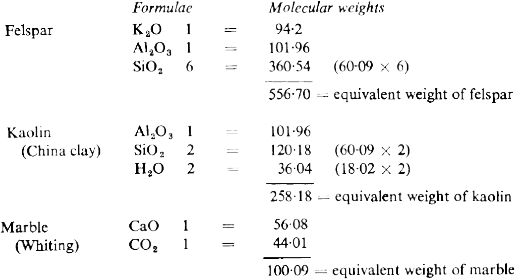
Así que podemos hacer una mezcla de los cuatro minerales que contenga igual número de moléculas de cada uno de ellos si pesamos las cantidades siguientes:
Feldespato 556,70
Caolín 258,18
Mármol 100,09
Cuarzo 60,09
Seger usa fórmulas unificadas para el vidriado
Volviendo ahora a las primeras pruebas de Seger para los conos, nos encontramos que probó las siguientes:
4 Primera serie de pruebas para la composición de los conos
Nº1 1 equivalente de feldespato con 1 equivalente de mármol
Nº2 1 equivalente de feldespato con 2 equivalente de mármol
Nº3 1 equivalente de feldespato con 3 equivalente de mármol
Nº4 1 equivalente de feldespato con ½ equivalente de caolín
Nº5 1 equivalente de feldespato con 1 equivalente de caolín
Nº6 1 equivalente de feldespato con 1½ equivalente de caolín
Al convertir estas recetas a fórmulas, Seger utilizó dos convenciones que han quedado establecidas y, desde entonces, son de uso común entre ceramistas. En primer lugar, ordenó los óxidos contenidos en las materias primas según sus valencias (la proporción de elementos oxígeno que contiene la molécula), un orden que se corresponde con la clasificación química de los óxidos como bases, anfóteros o ácidos. Utilizando R para representar cualquier elemento no gaseoso este orden queda de la siguiente forma:

Con las fórmulas escritas de esta manera no es fácil comparar de forma inmediata las relaciones entre las bases y la alúmina y la sílice, por ello a Seger se le ocurrió reducir los números a una relación fija por división. Para ello seleccionó como divisor la cantidad total de bases en la fórmula, de modo que, finalmente, su número quedase siempre la unidad. Reduciendo las fórmulas de esta manera, obtenemos:
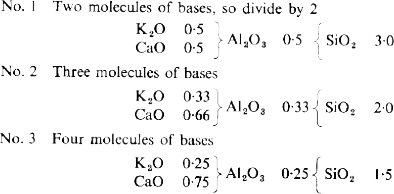
Así, puede apreciarse que cada incremento de mármol en la primera receta reduce la proporción de alúmina y sílice en las respectivas fórmulas. Quizás ahora sea evidente, pero Seger logró, mediante el uso de la fórmula unificada, escribir de forma clara las relaciones entre los diferentes óxidos del vidriado.
Para las recetas 4, 5 y 6, en las que se añade caolín en lugar de bases, las fórmulas quedan como sigue:
Nº4 K2O 1,5 Al2O3 7 SiO2
Nº5 K2O 2,0 Al2O3 8 SiO2
Nº6 K2O 2,5 Al2O3 9 SiO2
Seger establece el punto de fusión más bajo para sus materias primas
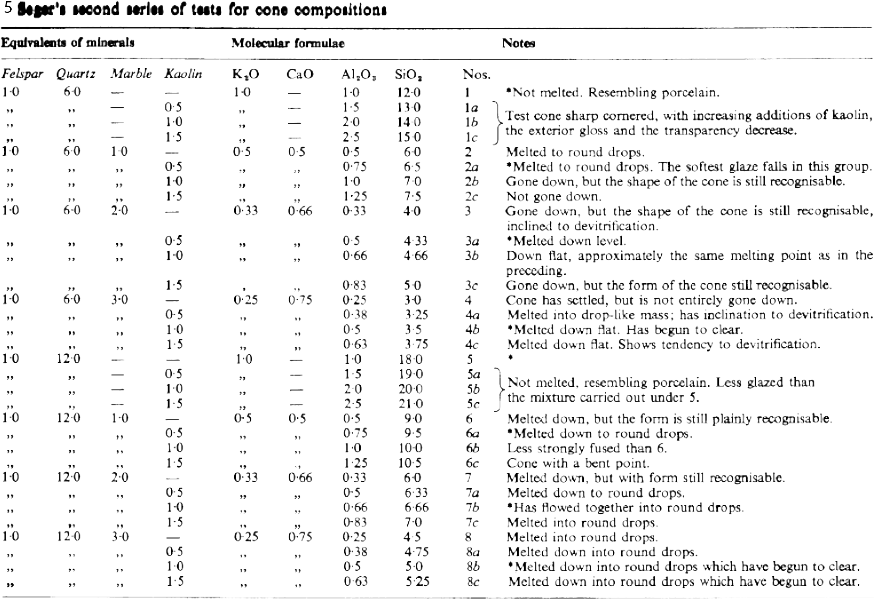
Ahora Seger tiene un método de escritura que le permite buscar reglas sistemáticas que controlen el proceso de fusión de las mezclas de materias primas para vidriados, e intentará hacer un amplio espectro de pruebas, alterando paso a paso las proporciones entre alúmina y sílice y entre las distintas bases. Las probetas para las pruebas se prepararon de nuevo en forma de conos y se cocieron a la temperatura a la que se dobla un cono hecho de feldespato puro. Los resultados comentados (donde los asteriscos indican la muestra más fusible de cada serie) corresponden a la tabla 5.
De las 32 pruebas, solo dos (las numeradas 4b y 8b) se licuaron y transformaron en vidrio tras el enfriamiento. Evidentemente, la facilidad de fusión no se deriva solo de un contenido bajo en alúmina o alto en base alcalina sino de alguna proporción concreta entre los diferentes óxidos. Para intentar llegar a dicha proporción, Seger realizó una nueva serie de 25 pruebas, cocidas de nuevo a la temperatura de reblandecimiento de un cono de feldespato. En este caso, estableció una proporción fija entre las bases y, manteniendo esta constante, introdujo modificaciones en las proporciones de alúmina y sílice, con los resultados que se muestran en la tabla 6.
La importancia de la alúmina
De nuevo, los resultados más fusibles en cada grupo de pruebas se han marcado con un asterisco, y esto ocurre en todos los casos cuando la alúmina se mantiene en 0,5 moléculas. Esto resulta bastante sorprendente e indica que la fusibilidad –al menos para vidriados que funden sobre los 1220ºC–, de alguna manera, es independiente del contenido de sílice si se mantiene la proporción entre las bases fundentes y la alúmina en 1:0,5. Como ya remarcó Seger, los ceramistas de su tiempo esperarían que la fusibilidad mayor correspondería a las pruebas con menor contenido de alúmina y también que la fusibilidad declinaría según se incrementase el contenido de alúmina. Pero, una vez más, la realidad contradice las expectativas.
Una nueva serie de pruebas reveló que la alúmina tiene otra función en los vidriados, que es la inhibición del crecimiento cristalino, tanto durante el calentamiento como durante el enfriamiento. Seger lo descubrió al repetir las pruebas con mezclas conocidas pero quitando todo el contenido de alúmina. Estas pruebas también ofrecieron explicación para sus primeros intentos fallidos, cuando utilizó conos de vidrio que estaban hechos sin alúmina.
La proporción entre las bases
Había, sin embargo, cierta diferencia entre la fusión de diferentes composiciones manteniendo la alúmina en 0,5 y Seger realizó una nueva serie de pruebas, manteniendo la relación 0,5:4 entre alúmina y sílice, para probar distintas proporciones entre las bases. Al escoger K2O = 0,2 y CaO = 0,8 (c en la siguiente tabla) en su serie anterior, Seger había actuado por intuición. Ahora, decidió probar otras variantes con los resultados que se ofrecen en la tabla 7.
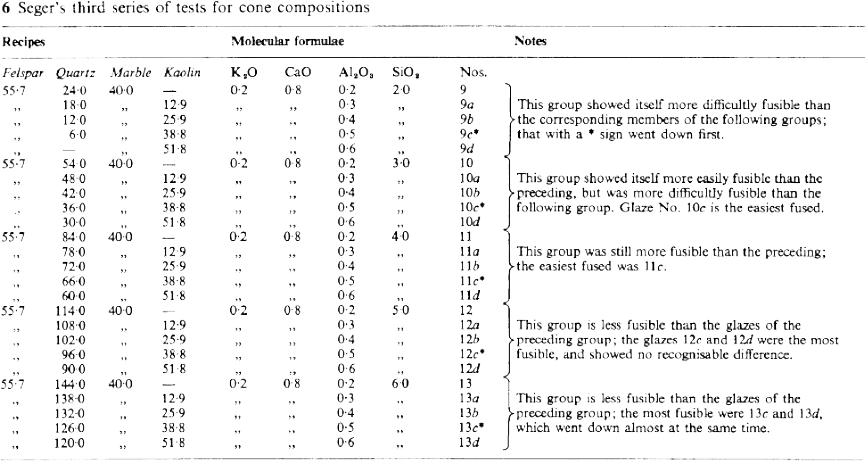
Por tanto, la relación entre las bases fundentes también es importante para la fusibilidad, y la siguiente fórmula representa el vidriado más fundente de la serie completa de 76 pruebas descritas en el artículo:
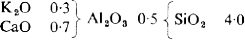
Conos para todas las temperaturas
El resultado más fusible entre todas las pruebas se eligió como receta para el primero de los conos, y se numeró con el nº 4 a causa de la proporción de sílice de su fórmula. Después, Seger puso en marcha las reglas que había descubierto y compuso otros conos que consideró fundirían a intervalos regulares por incrementos sucesivos de la proporción de alúmina y sílice respecto a unas bases fijas. La relación entre alúmina y sílice se fijó en 1:10 para el cono cinco en adelante:
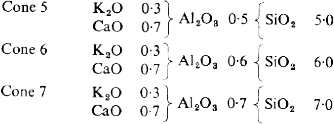
La tasa de incremento de alúmina y sílice se mantiene hasta el cono 10, después del cual, Seger consideró necesarios incrementos mayores hasta el cono 27. Más allá del cono 27, correlacionado hasta hoy con 1610ºC, las bases fundentes eran innecesarias y la fusibilidad se controlaba reduciendo la proporción entre sílice y alúmina, comenzando, en el cono 28, con diez moléculas de sílice por una de alúmina y acabando, en el cono 36 (1790ºC), con una y media de sílice por una de alúmina. En el cono 35 (1770ºC) la relación corresponde al caolín (1:2) y, de hecho, este cono estaba compuesto exclusivamente por caolín de Zettlitz. Los conos por encima del 36 fueron desarrollados en años posteriores por los colegas de Seger, y tres más han sido añadidos en época más reciente, llevando la serie hasta los 2000ºC.
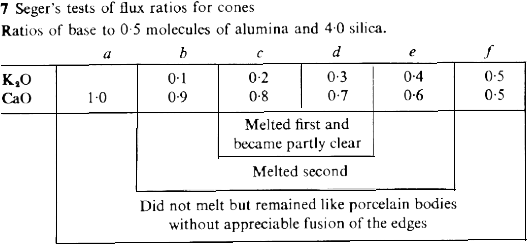
El cono 4 tiene el punto de fusión más bajo posible con los ingredientes inicialmente seleccionados por Seger para sus pruebas. Éste encontró, sin embargo, que sustituyendo algo de alúmina por óxido de hierro (ambos óxidos mantienen la misma relación entre metal y oxígeno, Al2O3 y Fe2O3) en pequeñas pero crecientes cantidades, era posible rebajar el punto de fusión, y Seger fue capaz de producir tres nuevos conos y bajar hasta 1100ºC.
Los conos lograron suficiente aceptación en la industria como para que Tonindustrie Laboratory dedicase el tiempo y dinero necesarios para desarrollar conos de temperaturas más bajas para decoración con pigmentos o metales nobles. Seger no llegó a trabajar en ello, pero en 1895, dos años después de su muerte, el trabajo estuvo finalizado. Para ello fue necesario cambiar de materias primas, a pesar de que el grupo de fundentes originales de Seger se pudo mantener hasta el cono 010 (950ºC) gracias a la introducción de cantidades crecientes de óxido de boro. Por debajo de este punto se cambió el grupo fundente al plomo y el sodio, manteniendo también una cantidad constante de boro. La reducción del punto de fusión se logró con una disminución constante de la alúmina y la sílice.
Seger no especificó correlaciones entre la caída de los conos y temperaturas concretas, pero indicó que el cono 1 se corresponde con el punto de fusión de una mezcla de 90% de oro y 10% de platino, que él situaba a 1145ºC. Prefería insistir en la idea de que la caída de los conos se identifica con las condiciones de maduración de las pastas y vidriados en el horno y que estos ofrecen un método consistente para controlar el proceso de cocción una y otra vez. Las correlaciones con temperaturas, sin embargo, fueron pronto establecidas y un conjunto completo fue publicado en 1907 (H. Ries: Clays, Their Occurrence Properties and Uses. John Wiley and Chapman Hall).
Después de un periodo de uso generalizado, comenzaron a experimentarse algunas dificultades con algunos conos, sobre todo aquellos con contenido de plomo o hierro, a causa de la reacción con ciertos gases en el horno, lo cual condujo a la modificación de las recetas cuyos números tienen la “a” en la tabla 8. En la época de la primera guerra mundial, los conos se habían hecho muy populares y se utilizaban en cualquier industria cerámica a lo largo y ancho de la Tierra. Desde entonces se ha investigado mucho al respecto y han surgido varias alternativas.
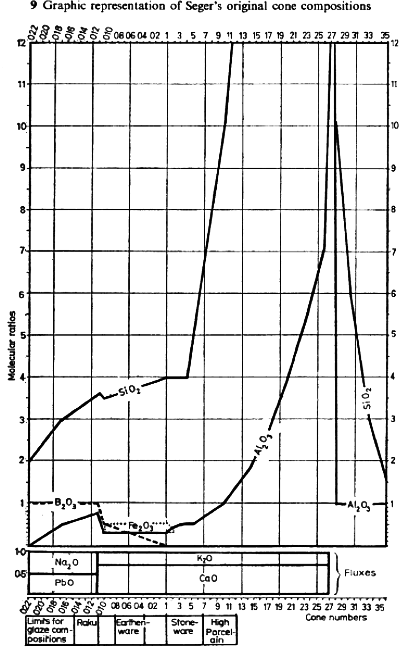
Las fórmulas originales de todos los conos están descritas en las tablas 8 y las variaciones de la composición se describen en la gráfica 9.
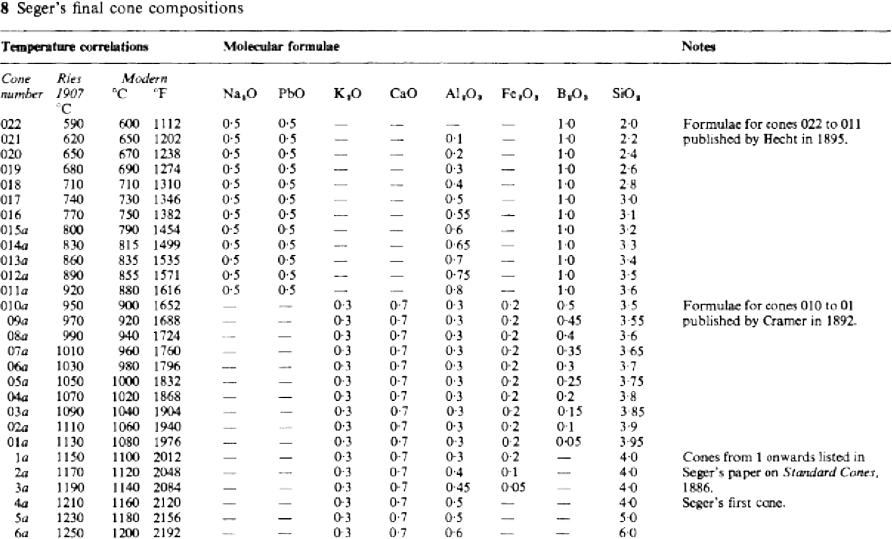
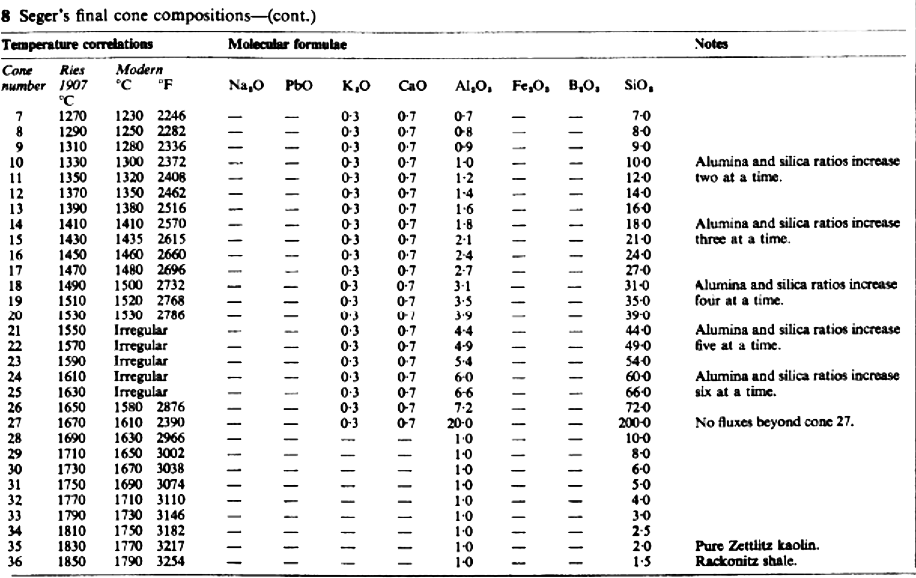
Notas para la tabla 8
Los conos 37, 38 y 39 se añadieron más tarde por Tonindustrie Laboratorium y en época posterior se ha incrementado la numeración hasta el nº 43 a 2000ºC.
Los conos marcados con “a” han sido alterados en su composición para evitar el uso de óxidos de plomo y hierro, así como para mejorar la correlación con sus correspondientes temperaturas.
Los conos deben colocarse en el horno en un ángulo establecido por su base, que debe quedar paralela a la superficie del horno. Deben protegerse del contacto directo con las llamas y tampoco deberían estar expuestos a gases sulfurosos o a corrientes de aire frío. Las correlaciones de temperatura pueden ser diferentes si los ciclos de cocción son anormalmente rápidos o lentos.
En la actualidad hay varias empresas fabricantes de conos y, como las correlaciones de temperatura pueden variar ligeramente, siempre es conveniente consultar los catálogos.
Bibliografía
- Arcilla y vidriado para el ceramista, Daniel Rhodes. Editorial CEAC, 1990
- A handbook of pottery glazes, David Green. Watson-Guptill Publications, 1979
- Introducción a la tecnología de la cerámica, Paul Rado. Editorial Omega, 1990
- Formulario y prácticas de cerámica, J. LLorens Artigas. Editorial Gustavo Gili, 1961
- Stoneware Glazes. A systematic approach, Ian Currie. Bootstrap Press, 1986
- Manual del ceramista, Bernard leach. Editorial Blume, 1981
- Vidriados cerámicos, Wolf E. Matthes. Editorial Omega, 1990
- The potter's dictionary of materials and techniques, Frank and Janet Hamer. Ed. A&C Black, 2012
- The complete guide to high-fire glazes, John Britt. Ed. Lark Crafts 2007
- Glazes cone 6, Michael bailey. Ed. A&C Black, 2010.