Teoría / El color
Introducción
El color es una sensación causada por la radiación electromagnética. Este es un enunciado muy sencillo, pero para entenderlo con profundidad hay que estudiar durante años. En este tema trataremos de escarbar la superficie del enunciado y, para ello, vamos a tratar de responder una serie de preguntas:
• ¿qué es la radiación electromagnética?
• ¿cómo se forman las sensaciones del color?
• ¿cómo se describen y representan los colores?
• ¿por qué hay tanta variedad de colores?
• ¿cómo logramos los colores en cerámica?
Radiación electromágnética
La radiación electromagnética es uno de los conceptos más fascinantes de la física, más aún desde que Einstein le diese un lugar central en su Teoría de la Relatividad al decir que la velocidad de la luz en el vacío es una constante de la naturaleza. Su magnitud es de unos 300.000 kilómetros por segundo.
La radiación electromagnética (RE, desde ahora) es uno de los fenómenos en los que se manifiesta la dualidad onda corpúsculo, es decir, a veces es una onda, a veces es una partícula, y otras veces es las dos cosas al mismo tiempo. A esa onda-partícula le llamamos fotón. Otra propiedad interesante de la RE es que para ella no pasa el tiempo, es decir, siempre permanece en el mismo instante en el que se produjo. También es el transmisor universal de señales. Por ejemplo, cuando leemos en un periódico que gracias al telescopio Hubble podemos ver las primeras galaxias que se formaron en el Universo, es porque la luz que enviaron al espacio esas primeras galaxias ha sido detectada por el Hubble tal y como era en el momento en que se produjo. Si el Sol explotase no nos enteraríamos hasta que llegase hasta nosotros la RE, que tardaría ocho minutos.
Volviendo a cosas más accesibles, en el tema de hornos vimos que uno de los mecanismos de transmisión del calor es por radiación, esto es, por generación e intercambio de RE, ya que la radiación RE es energía (o calor, que ya sabemos que es lo mismo). En las resistencias de un horno eléctrico, cuando circula corriente eléctrica se producen ciertos fenómenos que provocan la emisión de RE, es decir, de energía, y esta es la energía que va a cocer las piezas. En el horno vemos también otra característica de la RE, su color. Cuando el horno va ganando temperatura, a partir de unos 800ºC vemos cómo el horno se enciende. Al principio, por la mirilla lo vemos todo de un rojo tenue y oscuro, pero, según va subiendo la temperatura, el color va ganando en brillo y va pasando del rojo al anaranjado y amarillento. El color de la luz va cambiando.
Este ejemplo del horno nos va a servir para introducir el espectro electromagnético, que es la clasificación de la RE según su energía. En física se suele caracterizar la RE por su longitud de onda o por su frecuencia. Estas magnitudes son características de los fenómenos ondulatorios y, en realidad, son casi la misma cosa ya que, en el caso de la luz, están relacionadas por la ecuación: c(velocidad de la luz) = λ(longitud de onda)·ν(frecuencia)
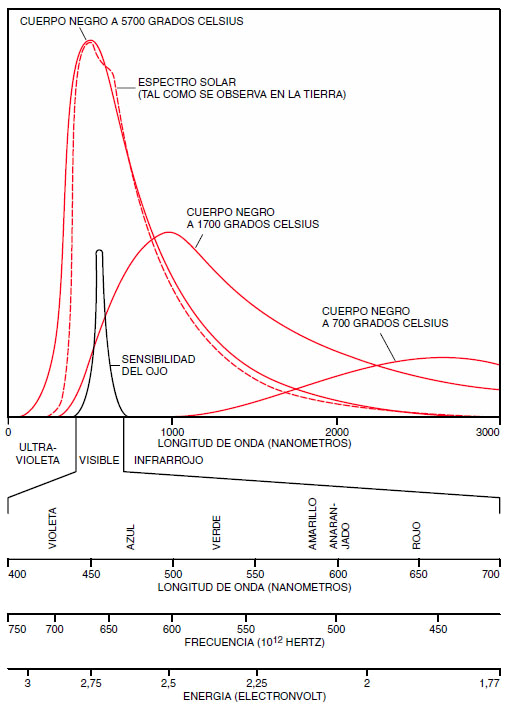
La longitud de onda, la frecuencia y la energía son otras tantas formas alternativas de caracterizar una onda luminosa. La energía es directamente proporcional a la frecuencia; tanto la energía como la frecuencia son inversamente proporcionales a la longitud de onda. En otras palabras, frecuencias y energías altas corresponden a longitudes de onda cortas, como es el caso del violeta en el espectro visible. Una unidad utilizada frecuentemente en la medida de longitudes de onda es el nanómetro, cuyo valor equivale a 10-9 metros. La energía de la luz se suele medir en electronvolt; un electronvolt equivale a la energía que adquiere un electrón cuando es acelerado por una diferencia de potencial de un volt. En términos de longitudes de onda, la visión humana se extiende desde los 700 nanómetros, en el límite entre la luz roja y la radiación infrarroja, hasta los 400 nanómetros, en el límite entre la luz violeta y la radiación ultravioleta. Expresado en unidades de energía, el mismo intervalo se extiende entre 1,77 electronvolt y 3,1 electronvolt.

En el gráfico se ve aumentada la región del espectro electromagnético a la que somos sensibles con la vista, el espectro visible, y también vemos los distintos colores según su longitud de onda medida en nano metros (1 nm es 10-9 m). También vemos que muchas otras cosas que conocemos también son RE, por ejemplo, los rayos X de las radiografías, las ondas que transmiten las señales de radio y televisión, etc...
Así que la RE está por todas partes, transmite la señal de nuestros móviles, el wifi en nuestra casa, calienta la leche en el microondas y, si tiene determinada energía, podemos verla con los ojos...a ver cómo funciona eso de los ojos.
El ojo y la visión del color
La luz entra al ojo a través de la córnea y forma la imagen en una capa llamada retina en la parte posterior del ojo, de modo que diferentes partes de la retina reciben luz desde diferentes partes del campo visual exterior. La retina no es absolutamente uniforme: existe un lugar, un punto, en el centro de nuestro campo visual, que utilizamos cuando tratamos de ver muy cuidadosamente las cosas, y en el cual tenemos la visión más aguda; se llama la fóvea o mácula. Las partes laterales del ojo, como podemos apreciar inmediatamente a partir de nuestra experiencia al mirar las cosas, no son tan efectivas para ver detalles, como lo es el centro del ojo. Existe también un punto en la retina de donde salen los nervios que llevan la información; éste es un punto ciego. No existe aquí parte sensible de la retina, y es posible demostrar que si cerramos, digamos, el ojo izquierdo y miramos directamente un objeto, y en seguida movemos un dedo u otro objeto pequeño lentamente hacia fuera del campo visual, súbitamente desaparece en alguna parte. El único uso práctico que de este hecho conocemos es que cierto fisiólogo llegó a ser todo un favorito en la corte del rey de Francia, a quien se lo dio a conocer; en las aburridas sesiones con sus cortesanos, el rey podía divertirse “cortándoles la cabeza", mirando a alguno y viendo desaparecer la cabeza del otro.
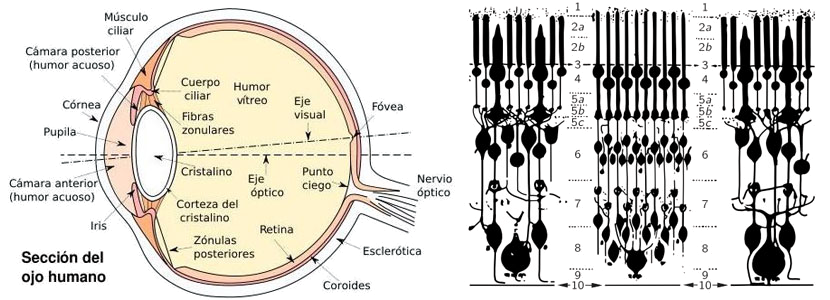
La figura derecha muestra una vista ampliada del interior de la retina en forma algo esquemática. En diferentes partes de la retina existen diferentes clases de estructuras. Los objetos que se presentan más densamente cerca de la periferia de la retina se llaman bastoncitos. Más cerca de la fóvea encontramos, además de estas células bastoncitos, las células conos. Describiremos más adelante estas células. A medida que nos aproximamos a la fóvea, aumenta el número de conos, y en la fóvea misma no hay otra cosa que conos, empaquetados en forma muy compacta, tan compacta que las células conos son aquí mucho más finas o delgadas que en cualquier otra parte. Debemos así apreciar que vemos con los conos justamente en el centro del campo visual, pero a medida que nos vamos a la periferia tenemos las otras células, los bastoncitos. Ahora la cosa interesante es que en la retina cada célula sensible a la luz no está conectada por una fibra directa al nervio óptico, sino que está conectada a muchas otras células, que a su vez están conectadas entre si. Hay varias clases de células: hay células que llevan la información hasta el nervio óptico, pero hay otras que están principalmente interconectadas “horizontalmente”. Existen esencialmente cuatro clases de células, pero no entraremos en estos detalles ahora.
Lo principal en que ponemos énfasis es que la señal luminosa ha sido ya "pensada". Esto quiere decir que la información desde las diferentes células no va inmediatamente al cerebro, punto por punto, sino que en la retina una cierta cantidad de la información ya ha sido digerida, por una combinación de la información desde diversos receptores visuales. Es importante comprender que ciertos fenómenos de la función cerebral ocurren en el ojo mismo.
Uno de los fenómenos más sorprendentes de la visión es la adaptación del ojo a la oscuridad. Si nos introducimos en la oscuridad desde un lugar brillantemente iluminado, no podemos ver muy bien durante un instante, pero paulatinamente, las cosas se hacen más y más notorias y, finalmente, podremos ver algo donde antes no veíamos nada. Si la intensidad de la luz es muy baja, las cosas que vemos son incoloras. Es sabido que esta visión debida a la adaptación a la oscuridad se debe enteramente a los bastoncitos, mientras que la visión en la luz brillante se debe a los conos.
A la luz brillante, aparentemente, los bastoncitos son de sensibilidad muy baja, pero en la oscuridad, a medida que pasa el tiempo adquieren su habilidad para ver la luz. Las variaciones en intensidad de la luz para las cuales uno puede adaptarse son mayores que un millón a uno. La naturaleza no hace todo esto con sólo una clase de célula, sino que traspasa su tarea desde las células que ven la luz brillante, las células que ven los colores, los conos, a las células adaptadas a las intensidades bajas, a la oscuridad, los bastoncitos. Entre las consecuencias interesantes de este desplazamiento están, primero, que no existe color, y segundo, que hay una diferencia en la brillantez relativa de objetos coloreados diferentemente. Resulta entonces que los bastoncitos ven mejor hacia el azul que los conos, y los conos pueden ver, por ejemplo, luz roja profunda, mientras que los bastoncitos la encuentran absolutamente imposible de ver. Así pues, la luz roja es negra en lo que concierne a los bastoncitos. Por lo tanto, dos trozos de papel coloreado, digamos azul y rojo, donde el rojo podría ser aún más brillante que el azul bajo una buena luz, aparecerán, en la oscuridad, completamente invertidos. Se trata de un efecto bastante sorprendente. Si estamos en la oscuridad y podemos encontrar una revista o algo que tenga colores y, antes de que sepamos con seguridad cuáles son, juzgamos las áreas claras y oscuras, y si luego llevamos la revista a la luz, podríamos ver este corrimiento bien notable entre el que era el color más brillante y el que no lo era. El fenómeno se llama efecto Purkinje.
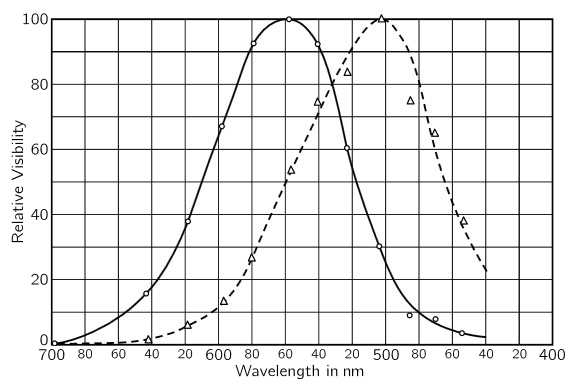
En la figura de arriba, la curva de trazos representa la sensibilidad del ojo en la oscuridad, es decir, utilizando los bastoncitos, mientras que la curva continua representa la sensibilidad a la luz. Vemos que la sensibilidad máxima de los bastoncitos está en la región verde y la de los conos está más en la región amarilla. Si se tiene una página de color rojo (el rojo está aproximadamente a 650 mµ) la podemos ver si esta brillantemente iluminada, pero en la oscuridad es casi invisible.
Otro efecto del hecho de que los bastoncitos entran en juego en la oscuridad y de que no existen bastoncitos en la fóvea, es que cuando miramos directamente algo en la oscuridad, nuestra visión no es tan aguda como cuando miramos hacia un lado. Una estrella tenue, o una nebulosa, se puede ver a veces mejor mirando un poco hacia el lado en vez de directamente hacia ella, porque no tenemos bastoncitos sensibles en el medio de la fóvea.
Ahora pasamos a la visión mediante los conos, a la visión de lo brillante, y llegamos al asunto que es más característico de la visión mediante los conos, y este es el color. Como sabemos, la luz blanca se puede descomponer por medio de un prisma en todo un espectro de longitudes de onda que nos parecen tener diferentes colores; esto es lo que son los colores, por supuesto: apariencias. Cualquier fuente luminosa se puede analizar por medio de una red de difracción o un prisma y se puede determinar la distribución espectral, es decir, la “cantidad” de cada longitud de onda. Una cierta luz puede tener mucho azul, bastante rojo y muy poco amarillo, o cualquier otra combinación. Esto es todo muy preciso en el sentido de la física, pero el problema es ¿de qué color aparecerá la luz? Es evidente que los diferentes colores dependen de alguna manera de la distribución espectral de la luz, pero el problema es encontrar qué características de la distribución espectral producen las diferentes sensaciones. Por ejemplo, ¿qué tenemos que hacer para obtener un color verde? Todos sabemos que podemos tomar simplemente una parte del espectro que sea verde. Pero, ¿es esta la única manera de obtener verde, o anaranjado, o cualquier otro color?
¿Hay más de una distribución espectral que produzca el mismo efecto visual aparente? La respuesta es, definitivamente, sí. Ahora bien, el asunto que debemos discutir es: ¿en qué condiciones aparecen diferentes distribuciones de luz como exactamente del mismo color para el ojo?
Parece ser que en el ojo existen tres tipos distintos de células receptoras de luz y por ello, según los individuos presenten deficiencias en alguno de estos tipos células, existen varios tipos de daltonismo. En relación con la existencia de tres tipos de células receptoras del color está el hecho de que podemos fabricar los distintos colores luz mediante la mezcla de luces de tres colores distintos. Esto suele representarse en el diagrama cromático, así que vamos a describir esto de la representación del color.
Descripción y representación del color
Es posible conseguir cualquier color luz, o color espectral, mediante mezcla de tres colores cualquiera siempre que ninguno de esos tres colores pueda obtenerse a partir de los otros dos. De este modo, podríamos escribir la siguiente fórmula para la creación de colores:
X = aA + bB + cC
X es el color que queremos obtener, A, B y C son los colores luz que utilizamos para hacer las mezclas, y a, b y c nos dan las proporciones de cada uno de los tres colores A, B y C. En realidad, hay un problema, que consiste, matemáticamente, en que puede no ser posible que existan tres números positivos a, b y c para lograr un color concreto, aunque siempre es posible si admitimos también números negativos, pero ¿qué significa un color en cantidad negativa?. Para entenderlo, debemos saber, que si dos mezclas diferentes de color son indistinguibles para el ojo, entonces cualquier adición de color igual que se haga sobre las dos mezclas, seguirá produciendo dos colores indistinguibles. De este modo, supongamos que tenemos cierto color Y que no es posible reproducir con mezclas de A, B y C. Resulta que sí va a ser posible encontrar una mezcla entre dos colores A, B o C que sea indistinguible de la suma entre Y más el tercer color A, B o C (el que no aparece en la mezcla anterior), es decir:
X + aA = bB + cC => X = bB + cC – aA
Así que, se interpreta el coeficiente negativo como que es un color que tenemos que añadir “al otro lado” para cuadrar los colores.
Resulta que si escogemos los colores luz verde, azul y rojo, las mezclas para obtener cualquier otro color son tales que precisan pocas veces de coeficientes negativos. Esto se representa en el siguiente gráfico, conocido como “diagrama cromático normal”
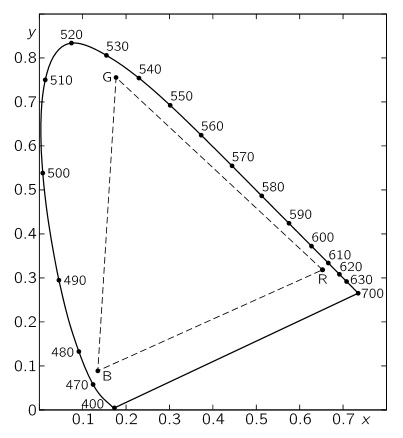
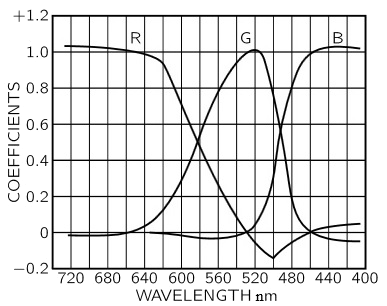
Todos los colores de dentro del triángulo cuyos vértices son el rojo, el verde y el azul, se podrían formar con coeficientes positivos. Para hacernos una idea del por qué del diagrama cromático podemos interpretar el gráfico siguiente, que nos da las diferentes proporciones necesarias para obtener los colores espectrales puros a partir del rojo, verde y azul. Las tres curvas representan las respectivas cantidades de rojo, verde y azul para obtener un color de una longitud de onda dada. Cuando alguna de estas líneas baja por debajo del cero para alguna longitud de onda, el coeficiente de ese color será negativo.
El color es un fenómeno psicofísico difícil de cuantificar porque depende de aspectos subjetivos de cada individuo, sin embargo, hay ciertas cualidades relacionadas que suelen medirse en relación al color. Tres de ellas pueden representarse en el denominado “sólido de color”, y son luminosidad, tono y saturación. El tono es el color en sí, lo que apreciamos como verde, naranja o azul; la luminosidad está relacionada con la claridad y el brillo, y se representa en un eje vertical con una escala de grises en la que el blanco está en la cima y el negro abajo; finalmente, la saturación es la intensidad del color. Una diferencia importante entre el sólido cromático y el espectro de la luz es que en este último no existen los púrpuras, que en el sólido enlazan los extremos del círculo, ya que se consiguen mediante mezclas de radiación de frecuencias altas y bajas.
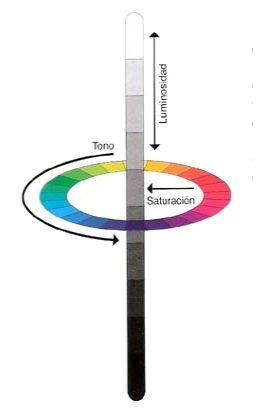
El tipo de mezclas de colores que hemos descrito hasta ahora se conoce como síntesis aditiva porque las mezclas de luces de distintos tonos producen nuevos tonos. Sin embargo, la mezcla de colores clásica de la pintura se conoce como síntesis sustractiva ya que, en este caso, los colores que vemos provienen de la radiación que no es absorbida por los pigmentos por lo que al mezclar distintos colores, el resultante corresponderá a las radiaciones que no hayan sido absorbidas por ninguno de los colores constituyentes, es decir, cada color de la mezcla sustrae cierto rango del espectro y el color resultante proviene del rango del espectro que no es sustraído.
Para acabar con esta breve introducción al color trataremos de describir por qué los objetos muestran diferentes colores y, en particular, los vidriados cerámicos.
Las causas del color
Las causas del color son muy diversas, pero todas ellas tienen el mismo origen: es la existencia de electrones en la materia, con sus variadas respuestas a las diferentes longitudes de onda de la luz, lo que hace que el mundo sea multicolor.
¿Cuál es el motivo de que el rubí sea rojo? ¿Por qué las esmeraldas son verdes? A un nivel superficial la respuesta a estas preguntas es muy simple. Cuando la luz blanca atraviesa un rubí, emerge de él con una proporción más elevada de las longitudes de onda mayores, es decir, aquellas que para el ojo humano constituyen el color rojo. Cuando la luz atraviesa una esmeralda, la distribución de longitudes de onda es diferente, correspondiendo en este caso al color verde. Aunque esta explicación del color es fundamentalmente correcta, resulta poco satisfactoria. Se echa de menos una comprensión de la forma en que la materia altera la composición de la luz que transmite o refleja. Tanto el rubí como la esmeralda deben su color a la presencia del mismo elemento como impureza. ¿Por qué razón su color difiere de forma tan radical? ¿Cuál es el origen de las diferencias en las distribuciones espectrales que constituyen los colores de los cuerpos?
Podemos suponer que el color que percibimos no es otra cosa que el resultado que proporciona la medida que lleva a cabo el ojo y la interpretación que realiza el cerebro de la longitud de onda, la frecuencia o la energía dominante de una onda luminosa. El significado de esta hipótesis está claro en el caso de una luz monocromática, cuya longitud de onda presenta un valor único y bien definido. En el caso de que la luz sea una mezcla de muchas longitudes de onda diferentes, la explicación resulta más complicada, pero son todavía las contribuciones relativas de las diferentes longitudes de onda las que determinan el color de los cuerpos.
Todas las interacciones de la radiación electromagnética con la materia vienen determinadas por un principio de la mecánica cuántica, según el cual los átomos tan sólo pueden existir en determinados estados discretos, cada uno de los cuales se caracteriza por poseer una determinada energía; las energías intermedias a éstas están prohibidas. Cada átomo se caracteriza por una energía mínima posible, correspondiente a lo que se denomina estado fundamental, y toda una serie de estados excitados de energías progresivamente más elevadas. Los estados de energía permitida se pueden comparar con los peldaños de una escalera, aunque hay que advertir que su espaciado es altamente irregular. La luz o cualquier otra radiación únicamente puede ser absorbida en el caso de que la energía que transporta sea exactamente la necesaria para promocionar a un átomo de un peldaño a otro superior. De forma análoga, cuando un átomo sufre una transición desde un determinado estado excitado hasta otro de inferior energía, emite una radiación cuya energía será igual a la diferencia entre las energías correspondientes a los dos niveles anteriormente citados. Esta energía aparece en forma de un fotón o cuanto de luz cuya frecuencia y longitud de onda vienen determinadas por dicha diferencia de energías.
La promoción de un electrón desde la capa que ocupa hasta la siguiente vacante electrónica es muy diferente según el nivel energético en que se encuentre el electrón. Los electrones apareados, de las capas más ligadas a los núcleos atómicos necesitan mucha energía para saltar de nivel, en cambio, los llamados electrones de valencia o electrones desapareados pueden hacer transiciones de menor energía. El color tiene su origen en las transiciones de este tipo de electrones.
Un ejemplo: El sodio
Como ejemplo, vamos a considerar el vapor del elemento sodio, cuya densidad es lo bastante baja como para que cada átomo se comporte independientemente de sus vecinos. El átomo de sodio tiene 11 electrones, pero 10 de ellos están situados en capas completas y tan sólo el electrón de valencia toma parte directamente en las interacciones de la luz con el átomo. Cuando el átomo de sodio está en el estado fundamental, el electrón más exterior ocupa un orbital designado como 3S1/2. Los niveles energéticos inmediatamente superiores (los siguientes peldaños de la escalera) se designan por 3P1/2 y 3P3/2 y les corresponde una energía de 2,103 y 2,105 electronvolt, respectivamente, por encima del estado fundamental. Estas son las cantidades mínimas de energía que puede absorber un átomo de sodio en el estado fundamental. Las longitudes de onda correspondientes son 589,6 y 589,1 nanómetros, respectivamente, y se sitúan en la región del amarillo del espectro visible.
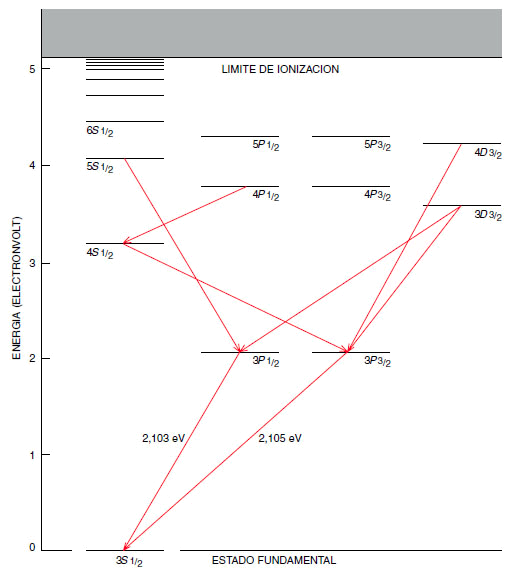
Por encima de los orbitales 3P existe una multitud de otros estados excitados, para los cuales la distancia media entre el electrón y el núcleo es mayor; lo mismo sucede con la correspondiente energía. De hecho, el número de tales estados es infinito, pero el intervalo entre los niveles se hace menor a medida que la energía aumenta, de forma que la serie converge hacia un límite finito (en el caso del sodio dicho límite vale 5,12 electronvolt). En tales condiciones, el electrón más exterior no está simplemente excitado, sino que se separa totalmente del átomo; en otras palabras, el átomo está ionizado.
Supongamos que un átomo de sodio se ioniza, quizá por efecto de un cuanto de radiación ultravioleta, y que el electrón libre y el ion se recombinan. Aun cuando el electrón puede ocupar en principio uno de los orbitales más altos, rápidamente se produce su caída hasta un nivel de energía menor. Si dicha transición tuviese lugar en una sola etapa, desde el límite de ionización hasta el estado fundamental, el átomo emitiría un fotón ultravioleta con una energía de 5,12 electronvolt. Un camino mucho más probable sería aquel que pasara a través de varios estados intermedios; en este caso, cada transición estaría acompañada por la emisión de otros tantos cuantos de energía menor. El número de cascadas posibles es limitado; ciertas “reglas de selección” determinan cuáles están permitidas. La mayoría de las transiciones permitidas que conducen al estado fundamental tienen lugar a través de alguno de los orbitales 3P. Como consecuencia de este hecho, los cuantos de luz amarilla con energías de 2,103 y 2,105 electronvolt se cuentan entre los emitidos. En realidad, estas dos líneas son, con mucho, las más brillantes del espectro del sodio atómico y son la causa de que el vapor de sodio excitado o ionizado emita una luz solar amarillo brillante.
La radiación amarilla característica de los átomos de sodio se puede observar al calentar este elemento con una llama cuya temperatura sea lo suficientemente elevada como para vaporizar a algunos de sus átomos. En química analítica esta propiedad sirve de base para los ensayos a la llama a fin de detectar la presencia de sodio. El doblete de líneas amarillas es también prominente en el espectro producido por las lámparas de vapor de sodio, en las cuales los átomos de dicho elemento están ionizados como consecuencia de una descarga de alta tensión.
También otros átomos producen líneas de emisión características al ser excitados o ionizados y retornar a continuación al estado fundamental; sin embargo, el espaciado de los niveles energéticos es diferente para cada elemento y, por tanto, el color de la luz emitida en cada caso es también diferente. En el caso del neón, las líneas más intensas se sitúan en la zona espectral del rojo, lo que explica el color rojo de las luces y señales de neón. Las líneas más prominentes del átomo de mercurio se sitúan en las regiones verde y violeta del espectro visible y, por consiguiente, las lámparas de vapor de mercurio proporcionan una luz azulada que es deficitaria en rojo y amarillo.
Las líneas de emisión y absorción muy bien definidas son típicas de los gases. En general, el espectro de la luz emitida por un sólido o un líquido es muy diferente del de los gases, en el sentido de que dicho espectro se extiende a lo largo de un intervalo continuo de longitudes de onda.
Una forma universal de la radiación que emite la materia condensada es la radiación del cuerpo negro, que constituye un espectro continuo con una forma característica. El término “cuerpo negro” se utiliza para referirnos a un material ideal que absorbe por igual a todas las longitudes de onda y que, al mismo tiempo, es también un emisor perfecto de todas las longitudes de onda. (Todos los materiales reales poseen una emisividad menor que la del cuerpo negro, pero muchos de ellos presentan un espectro parecido al del cuerpo negro para altas temperaturas.)
En la radiación del cuerpo negro ideal, el espectro es independiente de la composición química del emisor y viene determinado por un único parámetro: la temperatura.
A temperatura ambiente, las excitaciones térmicas se hallan confinadas en la región de bajas energías y sólo se emite radiación infrarroja. Cuando la temperatura alcanza unos 700 grados Celsius, la mayoría de las emisiones corresponden todavía al infrarrojo, pero ya empieza a aparecer un poco de luz visible, que corresponde al color rojo obscuro. Si la temperatura aumenta todavía más, el máximo de la curva de emisión se desplaza hacia la región de energías más altas y longitudes de onda más cortas, de forma tal que el cuerpo se hace más brillante y su color cambia. La secuencia de los colores se desplaza desde el rojo al anaranjado, amarillo, blanco y azul pálido, lo cual está de acuerdo con términos coloquiales tales como “rojo caliente” o “rojo blanco”, entre otros.
En un fuego de leña o en la llama de una vela, las partículas de carbón incandescente producen una radiación que corresponde a una temperatura de cuerpo negro del orden de 1500 grados Celsius, cuya luz se extiende del rojo al amarillo. El filamento de tungsteno de una lámpara incandescente alcanza una temperatura de 2200 grados y proporciona una luz blanco-amarillenta. La lámpara de un flash, capaz de alcanzar una temperatura de 4000 grados, proporciona una luz mucho más blanca.
El espectro solar tiene una forma muy parecida a la curva del cuerpo negro; dicha forma viene determinada por la temperatura de la superficie del sol, cuyo valor es del orden de 5700 grados C. En el espectro solar se pone de manifiesto la existencia de un máximo muy amplio centrado en 2,2 electronvolt, equivalentes a 560 nanómetros, es decir, una longitud de onda que corresponde al color amarillo verde. La sensibilidad del ojo es máxima precisamente para esta longitud de onda. De hecho, el concepto de blanco parece estar fuertemente condicionado por el espectro de la luz diurna, que a su vez está dominado por la radiación solar. En otras palabras, la luz que percibe el ojo humano nos parece blanca cuando su espectro se asemeja al de la luz solar; de hecho, podemos definir a los otros colores en función de su diferencia respecto al espectro solar.
Cuando los átomos se combinan para formar una molécula o se condensan para formar un líquido o un sólido, entran en juego nuevos modos de excitación. En particular, cabe señalar la aparición de vibraciones y rotaciones mecánicas, cuya existencia no es posible en los átomos aislados. Por ejemplo, los átomos de una molécula diatómica pueden oscilar como si estuvieran unidos entre sí por un muelle y, además, pueden girar alrededor del centro de masas de la molécula. Todos estos movimientos pueden influir ocasionalmente en el color de un material. Concretamente, la existencia de una deformación en las moléculas del agua produce la absorción de una pequeña cantidad de energía en el extremo rojo del espectro, dando lugar a la tonalidad azul característica que se observa tanto para el agua pura como para el hielo. Sin embargo, en la inmensa mayoría de los cuerpos, la energía de excitación vibracional y rotacional es muy pequeña y se disipa en forma de radiación infrarroja o calor.
Otra consecuencia de los enlaces interatómicos es el cambio que se produce en el estado de los electrones de valencia. En un átomo aislado, los electrones de valencia están desapareados y son la causa fundamental del color. Ahora bien, en las moléculas y en muchos sólidos, los electrones de valencia de los átomos forman pares con los electrones de valencia de los átomos vecinos; precisamente son estos pares los que constituyen los enlaces químicos que mantienen unidos a los átomos. Como resultado de la formación de dichos pares, las bandas de absorción de los electrones de valencia se desplazan hasta las longitudes de onda ultravioletas y ya no son aptas para la producción de color. Tan sólo aquellos electrones que permanecen en estados excepcionales pueden dar lugar a una coloración. Sin embargo, resulta evidente que tales estados excepcionales no pueden ser demasiado raros: si lo fueran, la mayoría de las moléculas y los sólidos serían transparentes a la luz visible.
En los elementos metálicos de transición, tales como el hierro, cromo y cobre, así como en los elementos del grupo de las tierras raras, aparece un conjunto de estados electrónicos excepcionales. Ciertas capas internas de los átomos de los metales en las series de transición permanecen sólo parcialmente llenas. Estas capas incompletas albergan electrones desapareados, cuyos estados excitados se sitúan frecuentemente en el espectro visible. Dichos electrones son los responsables de una amplia variedad de colores intensos. Por ejemplo, tanto el rubí como la esmeralda deben su color a que contienen pequeñísimas cantidades de cromo.
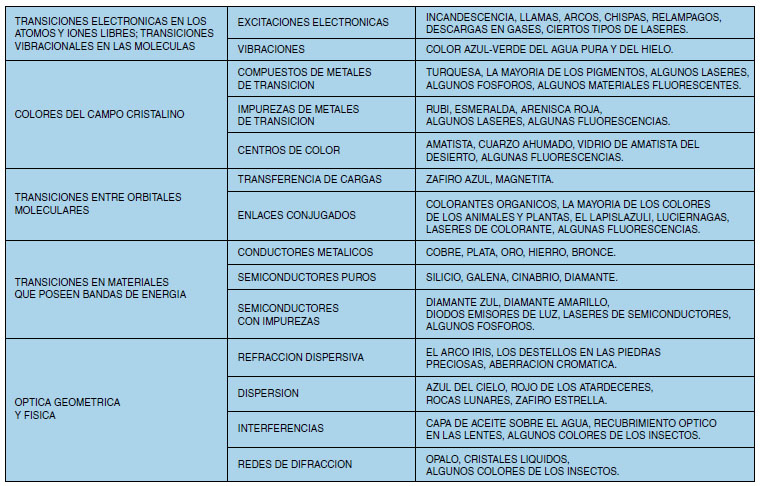
La explicación teórica sobre la formación del color en los distintos materiales está por encima del nivel de este curso. Simplemente, veremos un cuadro que resume las distintas teorías que se han elaborado para explicar las causas del color en diversos materiales.
El color en la cerámica
A partir de toda la información anterior y la experiencia que ya tenemos sobre los vidriados cerámicos, debemos tener unas nociones más o menos sólidas sobre el color en la cerámica. En este apartado final, trataré de sintetizar las diferentes cualidades de la cerámica en relación con la luz y el color.
Al apreciar una pieza cerámica hay tres características notables: brillo, opacidad y color. Las tres son consecuencia de la interacción entre la luz y el vidriado. Sobre el brillo y la opacidad ya hemos hablado a lo largo de este curso así que ahora solo haré un breve recuerdo.
El brillo es una cualidad superficial que depende de la reflexión de la luz. Cuando la superficie cerámica es muy lisa, la luz se refleja con la misma dirección de incidencia y el resultado es un brillo elevado, en cambio, si la superficie es rugosa, no hay una dirección predominante en la reflexión de la luz y la cerámica aparece mate.
La opacidad puede ser un efecto superficial, si la superficie cerámica refleja toda la luz incidente, en cuyo caso el vidriado será totalmente opaco, o un efecto de volumen, cuando parte de la luz penetra en el vidriado. En este caso podremos tener también opacidad, aunque de un tipo diferente, debida a la dispersión de la luz por las partículas que permanecen sin disolver en el seno del vidriado. Un efecto, como vimos, similar a la opacidad azul provocada en el cielo por la incidencia de la RE que, proveniente del Sol, llega a la atmósfera terrestre. En general, cuando el vidriado es homogéneo y no permanecen en éste partículas sin disolver, será transparente.
El color en la cerámica se explica por los mismos fenómenos que ya hemos descrito para dar cuenta del color de los objetos en general, y que podríamos resumir como las interacciones entre la luz y la estructura de la materia. Es decir, según los espectros de absorción que presente una composición de vidriado concreta, mostrará unos colores u otros. Dicha composición de vidriado depende de dos aspectos, la base del vidriado y los colorantes que le hayamos añadido, ya que un mismo colorante puede formar estructuras diferentes sobre diferentes bases de vidriados, lo que dará lugar a diferentes espectros de absorción y, por tanto, a colores distintos. Un ejemplo muy conocido es el del cobre, que suele dar verde con la mayoría de bases del vidriado, pero que aparece de color azul turquesa en los vidriados más alcalinos.
Un fenómeno que tiene bastante influencia en el color de la cerámica es la atmósfera del horno. Sabemos que los vidriados pueden mostrar colores muy diferentes según los cozamos en atmósfera oxidante o reductora. Estas diferencias de color también tienen su origen en las diferencias en cuanto a la estructura molecular que provoca la atmósfera del horno. Recordemos que el término reducción proviene de que al disminuir la cantidad de oxígeno en el horno, muchos de los compuestos sometidos a dicha atmósfera pasan de la forma con más oxígeno a la forma con menos oxígeno (o forma reducida), por ejemplo, el Fe2O3 se convierte en FeO. Esta alteración en la composición del vidriado, como es previsible, altera también su espectro de absorción y, en consecuencia, el color.
Como sabemos, la manera habitual de lograr cerámica coloreada es añadir óxidos colorantes a la pasta o al vidriado. En la siguiente tabla, se describen los colores que cabe esperar de los óxidos colorantes más utilizados. El primer número da el porcentaje necesario para conseguir una intensidad de color completa en el vidriado, y el segundo, entre paréntesis, es la cantidad necesaria para saturar el vidriado y que, normalmente, forma una costra metálica. En el caso de pastas coloreadas hay que introducir un peso de colorante unas cinco veces mayor para conseguir la misma intensidad de color.

La cantidad de colores, y sus diversas calidades y matices, que pueden lograrse en cerámica es inabarcable. Como ejemplo, puede consultarse el “Diccionario Akal del color”, que dedica más de diez páginas a la enumeración de la diversa terminología existente para describir la variedad de términos cerámicos asociados al color.
En estos apuntes vamos a enfocar la clasificación del color en la cerámica desde el punto de vista de las materias primas que producen el color y, dentro de estas, nos limitaremos a las materias primas crudas, es decir, no trataremos las fritas, ya que su descripción sería inabarcable, lo cual es fácil de ver con solo echar un vistazo al catálogo de fritas colorantes de un solo fabricante, por ejemplo, en este este enlace.
Así, nos vamos a limitar a la descripción de algunas de las posibilidades que se pueden lograr en cerámica mediante la incorporación de materias primas que contienen los siguientes elementos químicos: Ti, V, Cr, Mn, Fe, Co, Ni, Cu y Sb. El orden es el mismo en el que aparecen si recorremos de izquierda a derecha la cuarta fila de la tabla periódica, más el antimonio, que se sitúa un poco más a la derecha, en la quinta fila.
Además, nos limitamos a los colores de los vidriados. Los colores de los engobes, en general, no presentan tanta variedad y son más fáciles de clasificar. A pesar de todas las simplificaciones que hemos hecho para esta descripción, la tarea sigue siendo inabarcable, ya que el color no solo depende de la materia prima colorante sino también de la base del vidriado a la que se incorpora, y de toda la casuística típica de los vidriados como la aplicación de los mismos, el grosor de capa, la curva de cocción, la atmósfera del horno, velocidad de enfriamiento del horno, etc.
Ante de describir las características de los diversos óxidos colorantes, veamos una descripción general de los fenómenos que hay detrás del color cerámico.
El color se produce mediante tres procesos distintos, que pueden actuar por separado o conjuntamente:
1. Mediante coloración por disolución o por iones, cuando los compuestos colorantes se disuelven totalmente en la masa de vidriado fundido en forma de iones o se integran como tales dentro de cristales. En estos casos, según sea su coordinación con el oxígeno, producen diversos colores.
Estos suelen ser transparentes incluso cuando la intensidad del color es elevada. El verde cobre, el amarillo de hierro, el verde de hierro y el violeta de manganeso son típicos colores por disolución. La sustancia colorante debe disolverse completamente dentro del vidriado fundido.
2. Mediante coloración con pigmentos, cuando las sustancias colorantes se hallan finamente dispersas en el vidriado en forma de partículas colorantes. En este caso es deseable que el vidriado disuelva poca cantidad del pigmento, óxido colorante o partículas colorantes. Juntamente en el color propio del colorante añadido, aparece una opacidad causada por los pigmentos dispersos, es decir, los vidriados se vuelven opacos, pero coloreados. El verde de cromo, el pardo de hierro, el amarillo de vanadio, el amarillo de Nápoles, el rojo rosado, etc., son típicas coloraciones por pigmentos.
3. Mediante coloración coloidal, llamada también coloración «óptica», en la que el vidriado lleva en suspensión partículas coloidales submicroscópicas (tamaño aproximado 100 a 10 nm), que sólo absorben luz de determinadas longitudes de onda, de acuerdo con el tamaño de las partículas, reflejando tan sólo la luz roja (en el caso de cobre y oro metálicos), el azul (cobre metálico, gotículas de vidrio de boro, compuestos de titanio) o el amarillo (plata o bismuto metálico).
Si los óxidos que producen coloración no se disuelven en el vidriado fundido o sólo lo hacen en pequeña cantidad, aportarán su propio color como si fuesen pigmentos, de modo que, por ejemplo el CuO ya no dará color en verde sino negro volviendo el vidriado al mismo tiempo opaco.
Cuanto más altas son las temperaturas de cocción, tanto menos estables son los colores, ya que se disuelven demasiado en el vidriado fundido, se destruyen por efectos del calor o se desintegran en sus componentes no colorantes o pueden llegar a reaccionar con los componentes del vidriado.
Cuanto más bajas son las temperaturas de cocción, tanto más amplia es la posible escala de colores y tanto más brillantes podrán ser éstos.
A continuación se describen los óxidos colorantes de los elementos mencionados antes.
Óxido de titanio: TiO2. Óxido opacificante que provoca segregaciones cristalinas en el vidriado. Con porcentajes entre el 5% y el 10% el óxido de Ti crea un vidriado opaco con una superficie mate suave y agradable. Los cristales son diminutos y no se ven individualmente. Este tipo de vidriados, aunque opacos, son influidos por la base cerámica y, de algún modo, reflejan el color de dicha base, a veces, con intensidad.
El óxido de Ti se encuentra con relativa abundancia en la corteza terrestre. Es el noveno elemento más abundante, y el segundo colorante, tras el Fe. Por ello, su uso como colorante cerámico está bastante extendido.
El óxido de Ti se disuelve con facilidad en el vidriado durante la fusión, pero actúa como núcleo de cristalización, como titanatos, durante el enfriamiento. Provoca que el vidriado sea más refractario y, en los de baja temperatura, aumenta la viscosidad. Los efectos son variables según la base del vidriado. En proporciones bajas, alrededor del 1%, se disuelve totalmente en el vidriado sin provocar opacidad. En mayor proporción va aumentando la opacidad y la superficie mate. Algunos vidriados de plomo pueden llegar a incorporar un 25% de óxido de Ti.
El efecto sobre el color suele depender de la proporción. En pequeñas cantidades, intensifica el color y lo hace más brillante, por ejemplo, con el Fe se consiguen amarillos y naranjas brillantes. Con cantidades moderadas, entre el 2% y el 6%, se rompe el color provocando un moteado y, con cantidades mayores, aparecen brillos superficiales.
Como colorantes, suelen utilizarse más el rutilo y la ilmenita que el propio óxido de Ti. Ambos son minerales que consisten en TiO2 con impurezas de hierro. El rutilo contiene hasta un 15% de óxido de Fe. Es común utilizar combinaciones de rutilo, óxido de Sn y Fe2O3, para sacar colores crema, amarillo y naranja, y amarillos verdosos con óxidos de Co y Cu. Cantidades de rutilo alrededor del 10% provocan colores rotos debido a la cristalización. Se suele combinar con óxido de Sn para conseguir efectos de rayas o motas.
Matthes habla de vidriados amarillos de Ti. En baja temperatura, son vidriados de Pb en los que es bueno que haya B y algo de Fe es imprescindible. Este último podría provenir del rutilo.
Óxido de vanadio: V2O5. El pentóxido de V es el estado estable. Su color más característico es el amarillo. Se utiliza para preparar pigmentos amarillos junto al Zr y pigmentos azules junto al silicato de Zr. Da buenos amarillos con Pb, pudiendo admitir cantidades hasta el 10%, aunque nunca sale un color tan intenso como con el Sb. La ventaja del V sobre este último es que el V también puede utilizarse en alta temperatura.
Óxido de cromo: Cr2O3. Como materia prima, es un polvo de color verde, y ese mismo color es el que suele provocar. Tiene bastante poder colorante, así que no suele utilizarse en proporción mayor al 2%. Funciona bien tanto en baja como en alta temperatura, pero a partir de 1200ºC comienza a volatilizarse.
Como óxido, no se disuelve fácilmente en el vidriado, por lo que suele aparecer como un pigmento opaco disperso en el vidriado. En cantidades hasta el 1% se disuelve con más facilidad.
Los colores del cromo son bastante variables según la composición del vidriado. Por ejemplo, se pueden conseguir rojos y naranjas en vidriados de plomo, o rosas junto al estaño. Veamos los casos mejor conocidos:
- Verde de cromo: este es el color que aparece en la mayoría de composiciones. Una proporción hasta el 1% se dispersa y disuelve bien en el vidriado y produce un verde brillante en vidriados alcalinos, marrón verdoso en vidriados de boro y verde amarillento en vidriados de plomo. Con un 0,5% se puede obtener amarillo en vidriados de plomo. Si subimos hasta un 3%, la mayoría de vidriados serán opacos y de un verde grisáceo. Adiciones de Co producen tonos interesantes.
- Rojo de cromo: por debajo de 900ºC, pequeñas cantidades de cromo se disuelven bien en vidriados de plomo y provocan un rojo brillante. La alúmina estropea la calidad de este vidriado, por lo que es difícil su aplicación cerámica, excepto en formas planas. Para lograr un buen rojo, la atmósfera debe ser totalmente oxidante.
Los silicatos de Pb con muy poca alúmina son adecuados para este tipo de vidriados, y el Cr se puede introducir con dicromato potásico, ya que el fundente extra ayuda a disolver el Cr.
-Naranja de cromo: los rojos de Cr descritos se convierten en naranjas y amarillos cuando las temperaturas de cocción llegan, aproximadamente, a 950ºC y 1050ºC, respectivamente. En estos casos, la alúmina es más tolerable.
-Rosas de cromo y estaño: en estos vidriados el porcentaje de Cr suele estar entre 0,1-0,5%, y el de Sn entre 4-10%. Los mejores resultados suelen darse en mates de Ca que contienen menos del 5% de Sn y menos del 0,1% de Cr. El problema es que a las temperaturas de este tipo de vidriados (a partir de 1200ºC) el Cr es volátil.
Óxido de manganeso: MnO o MnO2. Produce negros, marrones y púrpuras. Cantidades hasta el 4% se disuelven en el vidriado, pero según vamos aumentando la proporción, el exceso se precipita en una superficie cristalina. Con alrededor del 20% se obtiene una superficie metálica.
Mezclado con óxido de estaño produce un color café agradable. En baja temperatura suele provocar moteados, pero sobre 1150ºC tiende a desaparecer el efecto.
El MnO2 comienza a descomponerse a MnO a 600ºC y, a 1080ºC, la descomposición es total. En una cocción lenta, por debajo de 1080º coexisten MnO2, MnO y Mn2O3 y en una base alcalina obtendremos colores púrpura. El MnO se combina casi inmediatamente con sílice y puede producir colores violeta. La amatista es sílice con impurezas de Mn. Cuando hay presencia de aluminio el color se amarrona, pero es un marrón purpúreo o azulado, muy diferente al del hierro. En bases alcalinas con muy poca alúmina, con un 1-3% de Mn se puede conseguir un violeta interesante. En un vidriado transparente de Pb, junto al óxido de Fe, se logran unos marrones con unos efectos rojizos preciosos al reflejar la luz del Sol.
La liberación de oxígeno que se produce a 1080ºC provoca importantes problemas de burbujeo en los vidriados que maduran a esa temperatura. Lo mismo ocurre al vidriar pastas de Mn.
Óxido de hierro: FeO, Fe2O3 y Fe3O4. Es el colorante más común utilizado en cerámica y da amarillos, marrones, rojizos, negros y grises. El FeO es “óxido de hierro negro”, el Fe2O3 “óxido de hierro rojo”, y el Fe3O4 magnetita. El óxido de Fe es muy común en muchos compuestos de la corteza terrestre y, por ello, su uso cerámico está bastante extendido desde tiempo inmemorial. La mayoría de las arcillas deben su color a los compuestos de hierro que contienen. La gama de colores que se pueden lograr con óxido de hierro es enorme, por ejemplo, el color de los celadones y tenmokus proviene del hierro. Así que, para clasificar el color del hierro vamos a incluir variables adicionales.
En oxidación, el óxido de hierro será Fe2O3 y los vidriados son amarillentos con una proporción hasta el 4%, bronces entre 4-6%, marrones entre 6-10% y marrón oscuro mate entre 10-25%. Este rango de colores se ajusta, sobre todo, a vidriados ricos en sílice con poca alúmina. El tamaño de partícula del óxido también es una variable importante.
En reducción tendremos FeO. El óxido de hierro es fácil de reducir. Entre 1-3% obtenemos un verde grisáceo desde pálido a oscuro y, a partir del 8% nos acercamos al negro. Sobre 1220º, si todavía quedan partículas de Fe2O3, comienza una transformación, según la siguiente reacción:
2 Fe2O3 → FeO· Fe2O3 + FeO + O↑
La partícula de FeO· Fe2O3 tiene la estructura de la espinela, que es bastante estable y difícil de reducir, y produce un color menos oscuro que el FeO, por lo que si queremos un reducción completa del Fe, hay que lograrla antes de alcanzar los 1220ºC.
En atmósfera neutra el color es un marrón menos interesante que los que se obtienen en oxidación o en reducción.
La proporción de óxido de Fe en el vidriado admite una variación bastante más amplia que otros colorantes, pudiendo llegar hasta el 25% en algunos tenmokus. La saturación de óxido de Fe en el vidriado, es decir, la aparición de cristales durante el enfriamiento, depende mucho de la composición del vidriado, de la temperatura, y de la variedad de Fe presente, y la variedad de efectos que pueden conseguirse es amplia.
Óxido de cobalto: CoO, CoO2, Co2O3, Co3O4. Hay varios estados de oxidación posibles para el óxido de Co, pero todos ellos producen el conocido azul cobalto. Es un colorante muy potente, ya que el 1% basta para saturar el vidriado de un azul muy oscuro. El azul puede presentar variaciones según los demás óxidos presentes en la composición del vidriado, pero estas variaciones son menores que las posibilidades que ofrecen la mayoría de óxidos colorantes. Tampoco presenta grandes variaciones al cambiar la atmósfera de cocción, y no se volatiliza hasta los 1400ºC.
En crudo, el estado de oxidación común es el Co3O4, de color negro, pero durante la cocción se transforma a CoO a unos 800ºC, liberando oxígeno. El CoO es estable a alta temperatura y la única variedad que se combina con la sílice para dar el color azul. La variedad Co2O3 es gris y también se utiliza en cerámica pero tiene un poder colorante ligeramente inferior a la de color negro.
El CoO actúa como fundente y se disuelve fácilmente en el vidriado, por lo que es difícil utilizarlo para decoración bajo cubierta ya que no mantiene la nitidez en las líneas.
Óxido de níquel: NiO, NiO2, Ni2O3, Ni3O4. En general, se usa más para combinar con otros colores que por el color que produce en solitario, que es un gris verdoso o marronáceo. Por ejemplo, los colores que produce junto al óxido de Cr son apreciados. A veces, en ciertas bases de vidriado, los resultados del Ni pueden ser sorprendentes.
Se comercializa en los estados NiO y Ni2O3, el primero puede ser verde o negro, aunque no hay diferencias entre ambos, y el segundo es negro. La forma NiO es la que permanece estable en la formación del vidriado, aunque a partir de 1200ºC se vuelve inestable y puede provocar defectos en el resultado.
Es un colorante intenso y su proporción límite suele estar sobre el 3%.
Óxido de cobre: CuO y Cu2O. Ambos óxidos tienen mucho poder colorante y una gama que va del verde al negro o en torno al rojo o marrón rojizo. En las pastas, el color varía entre el beige y el verde, dependiendo del grado de vitrificación.
Las materias primas que suelen utilizarse en cerámica son los dos óxidos mencionados más el carbonato de cobre, que es de color verde. El CuO es negro y el Cu2O rojo, aunque este último puede variar desde un rojo intenso al marrón, según la cantidad de estados de oxidación que haya en la mezcla.
El primer uso conocido del cobre en cerámica producía el conocido color turquesa de la pasta egipcia pero, en general, todas las variedades de cobre se oxidan a CuO y suelen producir verdes cuando está bien disuelto en el vidriado. Cantidades hasta el 2% provocan un verde intenso pero, si llegamos al 5%, obtendremos un negro metalizado.
El cobre es el óxido colorante que se disuelve con mayor facilidad en los ácidos, por lo que deben evitarse los vidriados con elevado porcentaje de cobre en la cerámica utilitaria. Además, en los vidriados de Pb, aumenta la solubilidad de este en los ácidos.
A parte del verde, es posible lograr gran variedad cromática con el Cu en función de la base del vidriado, aunque muchos resultados son difíciles de reproducir. Por ejemplo, los turquesas se dan en bases con Ba, Na y Li, combinaciones con Fe producen un buen amarillo verdoso, con Co verde azulado, con Mg se produce un moteado rosa, etc.
El óxido de cobre negro tiende a producir cierto moteado que puede evitarse utilizando el carbonato.
La cocción en reducción con Cu produce uno de los vidriados rojos más apreciados. Si se produce la reacción parcial 2CuO + CO → Cu2O + CO2, el color resultante es un marrón rojizo, pero si el óxido se reduce completemente a Cu metálico (Cu2O + CO → Cu2 + CO2), entonces el color es rojo brillante. Los mejores rojos suelen conseguirse sobre bases alcalinas, con cantidades de óxido de Cu menores que 0,5%, y añadiendo en torno al 1% de SnO2.
Óxido de antimonio: Sb2O3. Su uso más conocido es para lograr el amarillo de Nápoles en vidriados de plomo, en los que forma antimoniato de plomo (Pb3(SbO4)2). Este compuesto se puede introducir directamente en el vidriado, pero es muy tóxico. A parte de este uso, el óxido de Sb se comporta como opacificante, ya que no se disuelve en el vidriado, aunque resulta más caro que los opacificantes tradicionales, por lo que no es un uso común.
Bibliografía
- The Potter’s Dictionary – Frank and Janet Hamer – Fifth Edition – A&C Black. London
- Las causas del color – Kurt Nassau – Revista “Investigación y Ciencia” – Temas nº27. El color
- The Feynman Lectures on Physics – Richard P. Feynman y otros – Capítulos 35 y 36
Hay edición web gratuita en inglés aquí - Introducción al color – J. M. Gonzalez Cuasante y otros – Ed. Akal
- Manual de Mineralogía – C. Hurlbut y C. Klein – 4ª Edición – Ed. Reverté