Teoría / La fusión de los vidriados. Características y defectos
LA FUSIÓN
En algún momento hemos comentado que no hay ninguna diferencia fundamental, en cuanto a la composición, entre pastas, vidriados o engobes. La diferencia más importante es la fusión en el horno. Los vidriados se funden, mientras que las pastas cerámicas o los engobes, no llegan a hacerlo. Cuando se describió el proceso de maduración de las pastas, aprendimos qué es la sinterización. Estas etapas previas a la fusión, también suceden a los vidriados, pero estos van más allá, hasta la fusión.
Vamos a recordar las etapas que van pasando los materiales cerámicos en el horno, pero esta vez hasta el final del proceso, hasta la fusión. En primer, lugar se pierde el agua física que contengan las diversas materias primas, ya que el vidriado se aplica como una suspensión en agua, y ese agua debe evaporarse del todo, proceso que no acaba hasta una temperatura ligeramente superior a los 100ºC. Después, a temperaturas superiores, se van sucediendo una serie de fenómenos que van desde la descomposición de la materia orgánica hasta la transformación química de las diversas sustancias que componen el vidriado, por ejemplo, las arcillas y otras sustancias pierden el agua química, los carbonatos se transforman en óxidos con desprendimiento de CO2, y también pueden transformarse y recombinarse algunos silicatos. A estas temperaturas, alrededor de los 1000ºC, ya tiene lugar la sinterización de algunas pastas. Este es un fenómeno complejo, como vimos, que implica reacciones en estado sólido y cierta cantidad de sustancias líquidas fundidas, que es mayor cuanto más elevada es la temperatura de maduración de la pasta. Después de estos fenómenos, que en el caso de las pastas cerámicas implicarían la formación de una sustancia muy dura y resistente, y significa el final de la cocción, si seguimos aumentando la temperatura, la cantidad de fase líquida aumenta y, cuanto mayor es la cantidad de líquido, con más facilidad se va disolviendo la parte sólida en el fundido. Aquí podemos comentar la importancia de la granulometría fina de las sustancias que componen el vidriado, ya que podemos imaginar esas sustancias sólidas que se disgregan en la masa fundida como un tronco que se quema en la chimenea, es decir, cuanto mayor sea el volumen de la partícula, más tiempo va a necesitar para disolverse completamente en el fundido, pero si el tamaño de partícula es muy fino, la disolución se facilita bastante.
Al estudiar los vidriados, se suele considerar como un punto de partida adecuado el vidriado transparente y brillante. Este tipo de vidriado, se dice que tiene una “composición equilibrada” para su temperatura de cocción, lo que significa que todas las sustancias que componen el vidriado se funden totalmente a la temperatura de maduración y, además, tras el enfriamiento, permanece una sustancia lisa y homogénea o, lo que es equivalente, brillante y transparente. En un vidriado de este tipo, la fusión se ha completado, es decir, no ha quedado nada sin disolverse en el fundido y, además, la composición es tal que durante el enfriamiento el vidriado conserva el carácter homogéneo que alcanzó con la fusión completa. Pero, como podemos imaginar, las cosas no ocurren siempre de la misma manera, ya que entonces, la variedad de los vidriados se quedaría reducida a la mínima expresión. Lo que, desde un punto de vista teórico, son “desequilibrios en la composición del vidriado”, origina que el resultado de la fusión no sea transparente y brillante, sino toda la variedad de resultados más o menos opacos, más o menos brillantes, con diferentes texturas superficiales, etc.
La casuística de los vidriados ya hemos mencionado que es inabarcable. Aquí podemos comentar algunos resultados conocidos en relación con el producto de la cocción. Por ejemplo, están los vidriados transparentes coloreados. En ese caso, el agente colorante conserva identidad propia dentro del vidriado fundido y solidificado pero no altera la homogeneidad del mismo, permitiendo a la luz atravesarlo y reflejarse en la pasta sobre la que se aplicó, sin embargo, este agente colorante absorbe ciertas longitudes de onda, lo cual produce un color resultante en el vidriado; otro caso sucede cuando la composición del vidriado está saturada de algún óxido. Aquí puede ocurrir como al disolver azúcar en agua, que podemos echar azúcar hasta que saturamos la disolución, pero si entonces calentamos la mezcla podemos seguir disolviendo azúcar en ella, sin embargo, durante el enfriamiento el exceso de azúcar va a cristalizar produciendo una sustancia heterogénea. Esto mismo ocurre en los vidriados y, además, puede suceder de formas diversas, con resultados también diversos, algunos de los cuales veremos cuando tratemos los mecanismos de opacidad; otra variable, es la viscosidad del vidriado fundido. Hay vidriados que son muy fluidos en la fusión, hasta el punto de escurrir hacia abajo por las paredes del cacharro, mientras que otros forman un fundido muy viscoso, hasta el punto de que cualquier textura que hubiese sobre el vidriado crudo, se conserva tras la cocción. En este aspecto tiene bastante influencia la proporción de alúmina en el vidriado.
Hasta ahora hemos asumido, sin hacernos demasiadas preguntas, que las cosas se funden al elevar la temperatura, pero si nos preguntamos por las temperaturas de fusión de las diversas sustancias que componen los vidriados, el hecho de que estos realmente lleguen a fundirse, puede resultar bastante sorprendente. Por ejemplo, si nos fijamos en las temperaturas fusión de tres óxidos corrientes en cerámica, SiO2 (1710ºC), Al2O3 (2072ºC) y CaO (2572ºC), lo razonable sería creer que una combinación de estos óxidos nunca puede llegar a fundir a las temperaturas habituales en cerámica. Por otra parte, resulta sorprendente que el CaO, que es un fundente, tiene la temperatura de fusión más elevada de los tres. Estos fenómenos algo extraños, se explican a partir del concepto del eutéctico, que es bastante útil para ayudarnos a comprender la fusión de los vidriados.
La mayoría de materiales utilizados en cerámica son cristalinos y cambian de estado sólido a líquido al calentarlos a una temperatura conocida como "punto de fusión". Esta relación entre estado de agregación y temperatura es bastante simple cuando se trata de sustancias cristalinas puras y, en tal caso, el punto de fusión es la única temperatura en la que coexisten en equilibrio las fases sólida y líquida. A temperaturas inferiores solo existe sólido y a temperaturas ligeramente superiores solo existe líquido.
El diagrama de fases indica lo que sucede cuando ciertas composiciones se calientan, asumiendo que prevalecen condiciones de equilibrio. Tales condiciones de equilibrio requieren que no ocurran más cambios, independientemente de cuánto tiempo más se caliente una muestra a esa temperatura específica. Estas condiciones de equilibrio rara vez se alcanzan en la práctica.
Un sistema de dos componentes consta de dos constituyentes variables de manera independiente para los que podemos expresar la composición de cualquier punto en el diagrama. Por ejemplo, en la Figura 17-1, la composición de un punto se puede expresar como %A + %B. La escala de composición es la línea horizontal inferior; la escala de temperatura es el eje vertical. La composición en cualquier punto (P) se indica mediante una línea vertical trazada desde ese punto hasta la escala de composición. Así, la composición designada por el punto (P) es 30% B y 70% A.
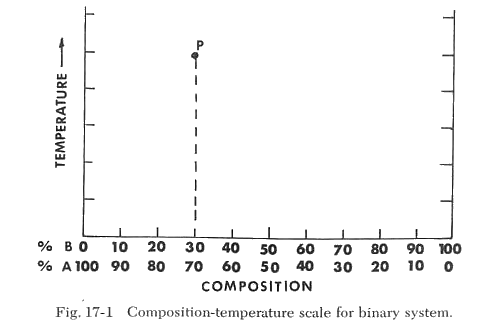
La escala vertical de temperatura proporciona una referencia que indica la temperatura en la que ocurren ciertos cambios cuando se calienta la composición especificada. Por ejemplo, si calentamos la composición 100% A, observamos la fusión a la temperatura Ta. Si solo calentamos B, encontramos que se funde a la temperatura Tb. Si calentamos mezclas de A + B y determinamos sus puntos de fusión, descubrimos que los puntos de fusión estarán en la línea Ta-Te-Tb, como se muestra en la Figura 17-2. Esta línea es la línea de liquidus y representa la temperatura máxima a la que los cristales pueden existir en equilibrio con el líquido. Por encima de esta temperatura, solo puede existir el líquido. El área por encima de la línea de liquidus se etiqueta como "líquido". Observamos que el punto de fusión de las mezclas de A y B varía y alcanza un mínimo en Te, correspondiente a 70% B y 30% A. Esta composición se llama composición eutéctica y la temperatura a la que se funde esta composición se llama "temperatura eutéctica". Esta es la mezcla de A y B que tiene la temperatura de fusión más baja. La temperatura eutéctica está representada por la línea Ea-Eb y es la temperatura más baja a la que puede formarse líquido en el sistema, como se muestra en la Figura 17-3. Si examinamos mezclas calentadas a una temperatura por debajo de la línea de liquidus pero por encima de la temperatura eutéctica, como se ilustra en el punto P de la Figura 17-3, encontramos una mezcla de cristales y líquido (vidrio). Si la composición está en el lado A de la composición eutéctica, la muestra consistirá en A + líquido. Si la composición está en el lado B de la composición eutéctica, la muestra consistirá en B + líquido.
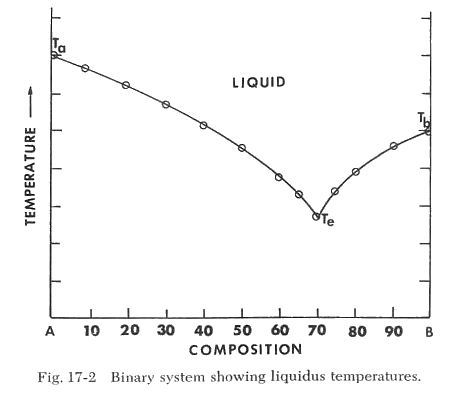
Si la muestra no se calienta por encima de la temperatura eutéctica (línea Ea-Eb), no se formará líquido. La muestra consistirá simplemente en nuestra mezcla inicial, cristales de A y B.
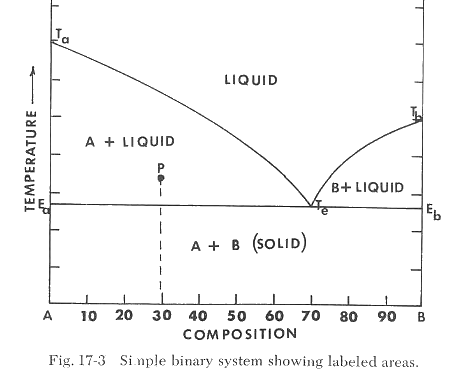
Ahora tenemos un diagrama de fases simple de dos componentes. Aunque muchos diagramas son más complejos, aún no es complicado identificar la temperatura de fusión para cualquier composición, la composición de la mezcla de fusión más baja y la temperatura en la que se produce la formación de vidrio o líquido. Estos son los puntos más importantes de interés para el ceramista.
En muchos casos, cuando los dos componentes A y B se mezclan en las proporciones adecuadas, se puede formar un compuesto AB. Esto se muestra mediante una línea vertical en el diagrama, como en la Figura 17-4. El punto de fusión del compuesto se reduce con adiciones de A o B y hay dos composiciones eutécticas en el diagrama. Una eutéctica tiene la composición 60% A y 40% B, y la otra 20% A y 80% B. En muchos casos, pueden formarse varios compuestos y resultar varias composiciones eutécticas.
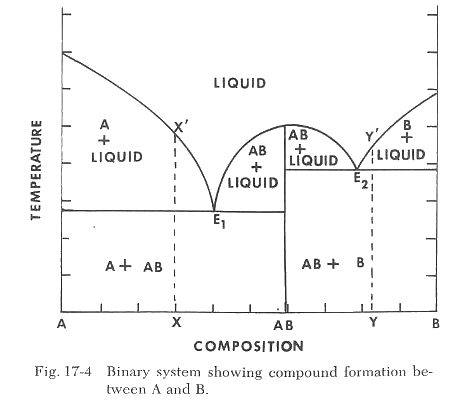
Ahora sigamos los cambios que ocurren cuando se calientan dos mezclas de A y B. La primera mezcla contiene 70% A y 30% B y está representada en la Figura 17-4 por la línea vertical discontinua X-X' que se extiende hacia arriba desde la composición indicada. Hasta que se alcance la temperatura indicada por la línea horizontal E1, que es la temperatura eutéctica entre A y AB, la mezcla contendrá solo A sólido y AB sólido. Sin embargo, cuando se alcanza la temperatura E1, comienza a formarse líquido en el sistema y la mezcla consiste en líquido + A sólido. A medida que la temperatura aumenta aún más, la cantidad de A sólido disminuye y la cantidad de líquido aumenta hasta alcanzar la línea de liquidus en X', momento en el cual se vuelve completamente fundido.
Si consideramos el mismo proceso de calentamiento para la composición indicada por la línea Y-Y', hasta que se alcance la temperatura E2, estará presente AB sólido + B. A la temperatura E2, comienza a formarse líquido y B + líquido está presente hasta que se alcanza la temperatura Y'. Por encima de esta temperatura, solo existe 100% de líquido. Observamos que la temperatura a la que se forma líquido por primera vez en un sistema dependerá de su composición y pequeñas diferencias en la composición pueden resultar en una gran diferencia en la temperatura a la que comienza la formación de vidrio. Si calentamos una composición que consiste en 60% B y 40% A, la formación de vidrio comenzaría a una temperatura de E2, pero una composición de 58% B y 42% A resultaría en la formación de vidrio a la temperatura más baja E1.
Examinemos dos diagramas reales que demostrarán las diferencias drásticas en la temperatura a la que tiene lugar la formación de líquido o vidrio. Se ha mencionado anteriormente que el FeO es un fundente fuerte en comparación con el Fe2O3. Conoces el efecto de la reducción al cambiar Fe2O3 a FeO, no solo en cuanto al color sino también en relación con la formación de vidrio y la densidad sinterizada de los cuerpos que contienen óxido de hierro. La Figura 17-5 muestra el diagrama de fases para el sistema FeO-SiO2. La observación de este diagrama muestra que se forma líquido a aproximadamente 1190°C, independientemente de la cantidad pequeña de FeO presente. Cuanta mayor sea la cantidad de FeO, mayor será la cantidad de vidrio (líquido) formado.
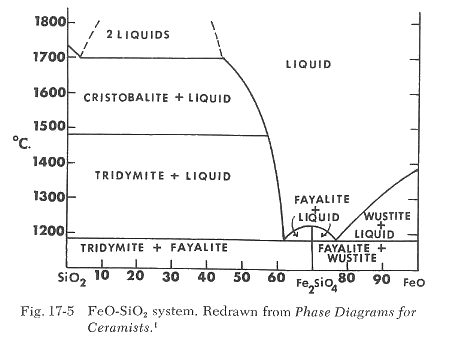
Si comparamos el diagrama de fases para la magnetita, Fe3O4-SiO2, en la Figura 17-6, con el diagrama anterior FeO-SiO2, notamos que no se forma líquido hasta alcanzar una temperatura de 1455°C. Esto es aproximadamente 265°C más alto.
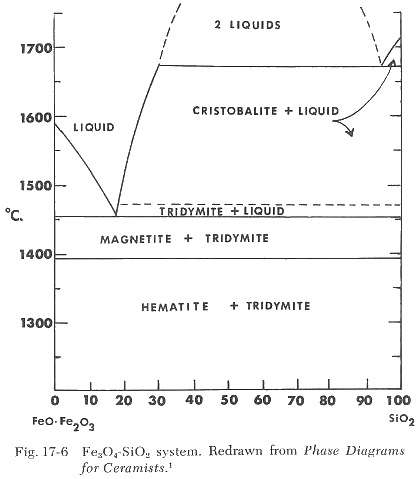
Esto explica las observaciones de que la cocción en reducción da como resultado temperaturas de maduración más bajas, cuerpos más compactos y un mayor desarrollo de vidrio. La reducción del cuerpo antes de la fusión del esmalte resultará en una disminución de la temperatura de maduración del esmalte debido a la formación de FeO en la superficie del cuerpo junto con su fuerte acción fundente.
Sistemas de tres componentes
Para representar visualmente un diagrama de equilibrio de fases de tres componentes, es necesario utilizar un triángulo equilátero para las escalas de composición, como se muestra en la Figura 17-7. Los tres vértices del triángulo representan el 100% de ese componente. Dividiendo los tres lados en partes iguales, de 0 a 100%, se puede determinar la composición porcentual de cualquier punto dentro del triángulo. Así, el punto X es 60% A, 20% B y 20% C, mientras que el punto Y es 40% A, 30% B y 30% C.
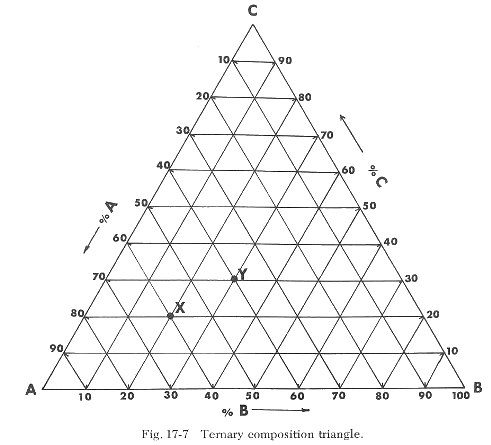
La escala de temperatura es vertical al plano del triángulo de composición. Esto da como resultado un modelo tridimensional, como se muestra en la Figura 17-8. Sin embargo, debido a los problemas del dibujo tridimensional, es mucho más conveniente si los sistemas ternarios pueden representarse en dos dimensiones. Esto se logra simplemente proyectando todos los puntos, líneas y superficies sobre la base del modelo espacial y luego indicando las temperaturas mediante líneas de igual temperatura llamadas "isotermas". La lectura del diagrama resultante no es muy diferente de leer un mapa de altitudes.
Los puntos de fusión más bajos se pueden identificar fácilmente mediante las isotermas, así como la dirección de las flechas en las líneas de límite. La Figura 17-9 es el diagrama para el sistema Na2O-Al2O3-SiO2. Con esta breve introducción, deberías poder localizar la composición de fusión más baja en el sistema y estimar el punto de fusión de diversas mezclas.
Se han publicado más de 1000 diagramas de fases que son de interés para el ceramista. Aunque la interpretación completa no es nuestro propósito, se puede obtener mucha información útil de los diagramas de fases con un esfuerzo mínimo.
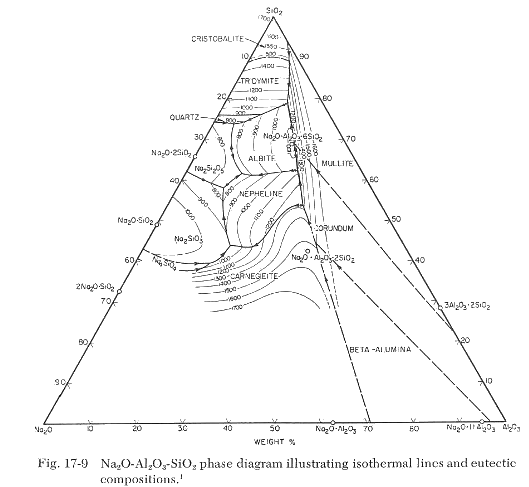
En el gráfico siguiente podemos ver, en un diagrama triaxial, los diversos eutécticos que se forman a partir de la mezcla CaO-Al2O3-SiO2
Las temperaturas que aparecen son las temperaturas de fusión de las correspondientes mezclas de los tres compuestos. En los vértices del triángulo figuran las temperaturas de fusión de los óxidos puros. De los eutécticos que se forman, el de menor temperatura corresponde a la fórmula CaO·0,348Al2O3·2,490SiO2 que, expresado en % para poder visualizarlo en el diagrama es 23,3%CaO; 14,7%Al2O3; 62,2%SiO2. Las composiciones de los otros eutécticos mostrados son:

CUALIDADES DE LOS VIDRIADOS
Algunos vidriados son transparentes: esto es, podemos mirar a través de la capa de vidriado y ver la pasta de arcilla o engobe que hay debajo. Otros vidriados son opacos y ocultan lo que hay detrás. La opacidad de los vidriados puede deberse bien a la naturaleza del vidriado en sí o a la presencia en él de agentes opacificantes. La transparencia puede entenderse como el estado normal de los vidriados, es decir, si un vidriado es cocido hasta su maduración y todos los óxidos de su composición alcanzan el estado de fusión completa, será normalmente claro y transparente. Muchos vidriados, incluso aunque no contengan ningún agente opacificante como tal, son turbios y opacos. Los vidriados infracocidos, por ejemplo, son opacos debido a la falta de fusión completa. Si la cocción se detiene antes de que el vidriado este completamente fundido, algún material sin fundir quedará suspendido en el vidriado. Estas partículas de materiales sin fundir pueden enturbiar el vidriado de forma parecida a la que el polvo añadido al agua forma una mezcla lodosa opaca. Los vidriados que son opacos debido a estar infracocidos se aclararán y se harán transparentes si la cocción continúa hasta el punto de la completa fusión del vidriado.

Otra causa de opacidad son las burbujas atrapadas en el vidriado. Estas pueden producir un efecto parecido a la espuma en el agua, que puede producir opacidad sin añadir ninguna partícula sólida real. Las burbujas en los vidriados normalmente son producidas por el desprendimiento de gas de los materiales volátiles que contiene. El aumento de la temperatura completa la reacción y, normalmente, aclara el vidriado.
Los vidriados opalescentes y, en consecuencia, opacos o semiopacos, pueden también ser el resultado de una mezcla de vidrios de diferentes índices de refracción. Este fenómeno se presenta con frecuencia en vidriados con alto contenido de B2O3. Tales vidriados pueden tener una textura lechosa blanco azulada.
Otra causa de opacidad es el desarrollo de cristales en el vidriado cuando se enfría de líquido a sólido. Los sólidos cristalinos dispersos en el vidriado o sobre su superficie, lo hacen opaco. Tales cristales pueden desarrollarse en el vidriado durante el enfriamiento, debido a un exceso de sílice, o a la presencia de rutilo y zinc en vidriados bajos en alúmina, o a partir de una cantidad excesiva de algunos óxidos colorantes tales como el hierro o el cobre. Normalmente, la presencia de una cantidad suficiente de alúmina en los vidriados evita la formación de cristales en ellos.
Si en la composición del vidriado se aumentan algunos óxidos más allá de sus límites normales para una temperatura dada, puede producirse opacidad. El óxido de cinc, el óxido de calcio, el óxido de bario, el óxido magnésico o la alúmina, si están presentes en una cantidad mayor a la normal pueden enturbiar el vidriado.
Los vidriados que son opacos como resultado de la infracocción, opalescencia, refracción, desvitrificación o desequilibrio de los óxidos, casi siempre se pueden aclarar si la cocción se lleva a un grado suficiente de calentamiento. Esto hace que, muchas veces, la opacidad de un vidriado sea un fenómeno incierto y la manera más segura de lograrla sea añadir un agente opacificante. Hay dos opacificantes de uso corriente: el óxido de estaño y el óxido de circonio. Ambos materiales tienen una baja solubilidad en el vidrio, es decir, no son disueltos fácilmente por el baño fundido y permanecen en el vidriado enfriado como diminutas partículas en suspensión, lo cual provoca la opacidad y blancura del mismo. Normalmente, el óxido de estaño y el óxido de circonio se añaden a un vidriado base que por sí solo es claro y transparente.
El óxido de estaño ha sido tradicionalmente el material preferido como opacificante. Este da a los vidriados una textura suave y agradable y realza los colores derivados de la mayoría de los óxidos colorantes. Alrededor de un 10% de estaño añadido a la mayoría de los vidriados los hace opacos, mientras que adiciones de menores cantidades lo hacen semiopaco. El óxido de circonio también da opacidad a los vidriados y puede sustituir al estaño. Normalmente se prepara como silicato de circonio combinando algo de sílice con el óxido de circonio. Para lograr el mismo grado de opacidad en los vidriados se tiene que añadir un porcentaje más alto de óxido de circonio que de óxido de estaño. El circonio puede elegirse como opacificante debido a que es más barato que el estaño, sin embargo, puede dar una textura algo más rugosa al vidriado y no favorecer ciertos colores como lo hace el óxido de estaño. El circonio puede también ser útil como opacificante en ciertos vidriados que contienen cromo, en los que la presencia del estaño producirá colores indeseados rosas y marrones. También el óxido de titanio puro puede tener propiedades útiles como opacificante, aunque su uso no está tan desarrollado.

Los vidriados semiopacos son aquellos que revelan parcialmente lo que hay bajo ellos, como un vidrio deslustrado. Son unos vidriados muy atractivos, aunque difíciles de controlar, por lo cual no suelen utilizarse en procesos industriales. En los vidriados semiopacos la temperatura de cocción y el espesor de la capa se convierten en factores críticos. Si la capa aplicada es gruesa, el vidriado puede salir opaco, pero si es muy delgada puede salir transparente. También, si el vidriado semiopaco se sobrecuece puede aclararse y quedar demasiado transparente, pero si se infracuece puede resultar demasiado opaco.
Mecanismos de opacidad
Muchos vidriados contienen «impurezas» en la capa vítrea homogénea, sin que éstas se puedan reconocer como tales a simple vista y sin que por ello se estropee la capa del vidriado, con un tamaño aproximado de 50 a 200 nm. Este es el caso, sobre todo, de los vidriados blancos opalinos y brillantes y de los vidriados brillantes coloreados mediante pigmentos. Estos vidriados dejan pasar la luz de forma muy limitada. Esta turbidez se hace tanto más marcada, cuanto menores y mas numerosos sean estos «entorpecimientos», que pueden estar formados por partículas no fundidas de la mezcla, cristalitos de nueva formación, burbujitas o gotículas desprendidas.
Los vidriados opacos son más o menos opacos con una superficie casi siempre lisa y brillante. En muchos casos han de ser blancos o incoloros y tapar un fondo de algún modo coloreado. Corrientemente, su poder cubriente ha de ser lo mejor posible, para que haya bastante con una capa de poco espesor.
La opacidad blanca se origina por refracción y reflexión de la luz incidente en el mayor número posible de límites de fase, bien estructurados, de la capa del vidriado, de modo que los rayos lumínicos se dispersen fuertemente. Cuanto más fina sea la dispersión de una fase de diferente composición en la capa de vidriado, y cuanto más se diferencie su índice de refracción del de la matriz del vidriado, tanto más intensa es la opacidad. Para ello es teóricamente indistinto si la fase dispersa es sólida y cristalina, líquida o gaseosa. Se alcanza el óptimo de opacidad cuando las partículas dispersas (o burbujitas o gotículas) tienen un tamaño entre 2 nm y 200 nm. Pueden distinguirse cuatro mecanismos de opacidad diferentes:
1. Opacidad por pigmentos:
Los pigmentos cristalinos que se añaden a la mezcla hacen opaco el vidriado por su dispersión lo más fina y regular posible. Para ello es necesario que estas sustancias estén molidas muy finamente, lo que, por su parte, las hace fácilmente solubles. Los vidriados fundidos no deben diluir estos opacificadores. Si las partículas opacificadoras se disuelven, no se forman unos bordes tan delimitados entre los límites de los granos y el efecto opacificador disminuye.
Sólo hay pocas sustancias que no sean disueltas y atacadas por los vidriados fundidos o que no reaccionen químicamente con la masa fundida y sus componentes: tan sólo el óxido de estaño SnO2, el Óxido de cerio CeO2, óxido de antimonio Sb2O3, óxido de circonio ZrO2, y el silicato de circonio están indicados por su pura opacidad blanca, si bien no en todos los casos se puede lograr una distribución regular y homogénea en el vidriado. Para este efecto opacificador no son apropiados las masas de vidrio fundidas de gran poder de disolución, así como en casos aislados, algunas composiciones especiales de vidriado.
2. Opacidad por segregaciones:
Esta opacidad se produce por la segregación de numerosos cristalitos muy diminutos durante el enfriamiento. Hay que procurar que se favorezca la formación de la mayor cantidad de núcleos cristalinos posible. Una cristalización de este tipo, de elevado índice de refracción, significa al mismo tiempo unos límites muy claros entre las fases y una distribución regular, dado que las sustancias cristalinas que se forman habían estado antes disueltas total o, por lo menos, parcialmente, en la masa fundida. De esta manera se produce un buen efecto opacificador. Una opacidad óptima presupone una viscosidad adecuada de la masa fundida y una correcta velocidad de enfriamiento, a fin de que las partículas obtengan el tamaño correcto. Como medio opacificador sólo están indicados el óxido de titanio y el silicato de circonio.
Indices de refracción de diversos medios opacificadores (los datos de las bibliografias varían):

Normalmente, los vidriados presentan un índice de refracción de 1,50 a 1,55.
3. Opacidad por desmezclado:
Esta opacidad se produce a causa del desmezclado de la masa fundida en dos fases liquidas, dispersándose una de las fases en forma de gotículas dentro de la masa fundida restante. En este caso y según sea la mezcla, la fase dispersa puede solidificarse de forma vítrea (en los vidrios de borato) o cristalina (en las opacidades de fosfato). Aquí las diferencias entre los límites de refracción no son tan grandes, de manera que una opacidad de este tipo no es muy vistosa.
Al mismo tiempo, el desmezclado en gotículas puede favorecer la segregación de una fase cristalina opacificadora que actúa como germen de cristalización.
En la opacidad por borato han de actuar conjuntamente las mezclas correctas de B2O3, ZnO y CaO en un vidriado con un elevado contenido de SiO2. Para conseguir la opacidad por fósforo se utiliza generalmente fosfato de calcio.
4. Opacidad gaseosa:
La formación de diminutas burbujas de gas dentro de la masa fundida viscosa tiene un efecto fuertemente opacificador y seria el método opacificador más barato. Sin embargo, no es lo suficientemente segura, porque todas las burbujitas tienden a unirse en forma de burbujas mayores y las masas de vidriado fundidas han de tener una viscosidad muy alta, lo que, por otra parte, hace que la superficie se alise con dificultad.
Esta clase de opacidad se puede observar con frecuencia en los barnices de feldespato, sumamente viscosos; únicamente se puede aprovechar cuando la capa de vidriado es extremadamente viscosa y en la mezcla hay una elevada proporción de cuarzo. Por otra parte, las burbujitas también pueden actuar de centros de cristalización para opacidades cristalinas.
Por regla general, la mejor manera de elaborar opacidades seguras es usando pigmentos o por fases cristalinas segregadas; a menudo la combinación de varios mecanismos opacificadores da un vidriado más fiable y barato.
Vidriados brillantes y mates
Las superficies de los vidriados pueden ser más o menos brillantes, reflectantes y relucientes. Un vidriado que tiene una superficie apagada, falta de brillo o reflejos, se dice que es mate. Un vidriado completamente fundido es propenso a tener una superficie brillante reluciente. Esto es así porque el vidriado, al fundirse, se nivela y alisa a una superficie plana y uniforme. Esta lisura de los vidriados es una de sus características prácticas; una superficie lisa es higiénica, fácil de limpiar y no acumula suciedad y gérmenes en hoyos y hendiduras.

Si un vidriado no se funde completamente en la cocción o si su viscosidad es todavía alta a la temperatura de maduración, la superficie del vidriado es propensa ser ligeramente rugosa y, por lo tanto, más o menos mate. El enfriado lento también favorece las superficies mate, sobre todo si ésta es el resultado de cristalizaciones en la superficie del vidriado. Tales vidriados mate se denominan criptocristalinos para diferenciarlos de los vidriados que tienen grandes cristales visibles.
Un exceso de óxido bárico de alrededor de 0,2 moles producirá matidez en la mayoría de los vidriados, pero no en los que contienen abundante B2O3, ya que este óxido forma un eutéctico con el bario produciendo un vidrio fluido. Las propiedades de matidez y opacidad están relacionadas, ya que un vidriado mate también suele ser opaco, porque la rugosidad de la superficie que causa la matidez no permite la transparencia.
Acabamos este apartado remarcando una diferencia sobre la fenomenología de los vidriados transparentes y los brillantes. El brillo es un fenómeno que solo depende de la superficie del vidriado, y la capa interna del mismo no tiene ninguna influencia en el brillo, sin embargo, en el caso de la opacidad, bien podría producirse por un fenómeno de la masa del vidriado, aunque hay veces en que la opacidad es también un fenómeno de superficie.
En general, las cualidades de los vidriados alcanzan todas las posibilidades intermedias y casi todas las combinaciones posibles, es decir, hay vidriados transparentes y mates, transparentes y brillantes, opacos y brillantes y opacos y mates, y también toda la amplia variedad de cualidades intermedias.
DEFECTOS DE LOS VIDRIADOS
Compatibilidad entre la pasta y el vidriado
El vidriado de la cerámica cumple muchos propósitos, tanto utilitarios como decorativos. Pocas cosas son más atractivas que una pieza vidriada de forma hermosa. Por otro lado, hay poco que decir sobre una pieza en la que el vidriado y el cuerpo no son compatibles, ya sea estéticamente o mecánicamente.
Las composiciones de vidriado, cálculos, tipos de vidriados, métodos de aplicación y cocción de vidriados han sido presentados y discutidos de manera excelente por Rhodes y Norton. Poco se puede añadir a estas excelentes presentaciones. En consecuencia, aquí discutiremos algunos aspectos del ajuste del vidriado al cuerpo y algunos de los defectos del vidriado que resultan de una mala adaptación.
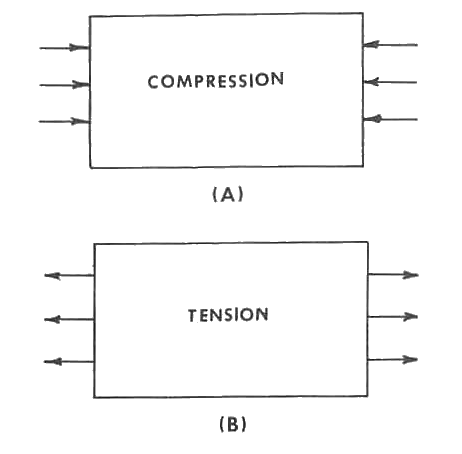
El concepto fundamental para entender el ajuste del vidriado es el de compresión y tensión. Si una pieza está sometida a presión en ambos lados, como en la figura a, estará bajo compresión. Si la fuerza aplicada tiende a estirar o alargar la pieza, estará sometida a tensión (o tracción) (figura b). Es propio de materiales quebradizos, como la cerámica, ser fuertes en compresión pero débiles en tensión. Por lo tanto, se deduce que un vidriado bien ajustado y estable debería estar en compresión.
La propiedad física de un cuerpo y de un vidriado que determina la magnitud de la compresión o tensión es la expansión térmica. Esta es la cantidad en la que un material se expande cuando se calienta y se contrae cuando se enfría. La expansión, o dilatación, térmica de un cuerpo o vidriado depende, en su mayor parte, de su composición e historial térmico. Dado que la composición del cuerpo y del vidriado puede variarse de forma independiente, el alfarero tiene la oportunidad de ajustar la expansión térmica de uno o ambos para lograr un ajuste adecuado del vidriado.
Dilatación del vidriado
La discusión del primer tema sobre la estructura del vidrio ha mostrado algunos de los factores involucrados en las propiedades de expansión de un vidrio. El vidrio de sílice pura tiene uno de los coeficientes de expansión más bajos de cualquier material, 5.5·10-7. A medida que se añaden fundentes, como Na2O, K2O, CaO y MgO, al vidrio de sílice, la dilatación se incrementa. Este efecto se debe a los iones adicionales de O-2 añadidos por encima de la cantidad requerida para satisfacer los requisitos de coordinación tetraédrica del ion Si4+. Este oxígeno adicional descompone la estructura tridimensional del vidrio de sílice, debilitando así la estructura y resultando en un coeficiente de expansión más alto. Como regla general, cuanto mayor sea la cantidad de oxígeno presente, mayor será la expansión, o dicho de otra manera, cuanto mayor sea la relación oxígeno-silicio, mayor será la dilatación.
La adición de B2O3 a un vidrio de sílice-sodio resulta en una disminución del coeficiente de expansión del vidrio resultante debido a la capacidad del ion B3+ para enlazar el oxígeno adicional suministrado por una adición de fundente, como Na2O, en una coordinación tetraédrica. Esto mantiene la estructura tridimensional fuerte del vidrio que tiene una menor expansión. Las discontinuidades en la estructura disminuyen y hay menos puntos débiles en la estructura del vidrio. Esta es la base de los vidrios sódicoborosilicatados utilizados en utensilios de cocina. El coeficiente de dilatación de estos vidrios es de 32·10-7.
Debido a la necesidad de formular vidriados que maduren en el rango de temperatura adecuado, produzcan la textura superficial deseada (brillante o mate), tengan características adecuadas de viscosidad y cobertura, así como el color requerido, es obvio que el número y los tipos de composiciones de esmalte son prácticamente ilimitados. Cada adición de óxido utilizada para producir una característica deseada tiene su propio efecto individual en la expansión térmica.
En un sistema vítreo, el coeficiente global de dilatación (α) depende de la composición química. Cada óxido componente contribuye con su participación particular a la expansión total. La expansión total (α) se puede calcular mediante la siguiente expresión:
α= α1x1+ α2x2+ … + αnxn, donde x1, x2, etc son los porcentajes en peso de cada óxido componente y α1, α2, etc son los coeficientes de dilatación para ese óxido.
McLindon y West han investigado casi doscientos esmaltes comerciales y, mediante cálculos computacionales, han llegado a coeficientes de expansión para cada óxido. Se descubrió que, para lograr una buena correlación, era necesario eliminar los esmaltes que contenían Li2O, SrO y F. Estas adiciones causan efectos anormales de expansión. La Tabla 11-1 proporciona los coeficientes de expansión lineal para los diversos óxidos.

El histograma de abajo muestra la correlación entre los coeficientes de expansión calculados y medidos de aproximadamente setenta fritas "Ferro" utilizando los coeficientes de McLindon y West, en comparación con los coeficientes de Winklemann y Schott.
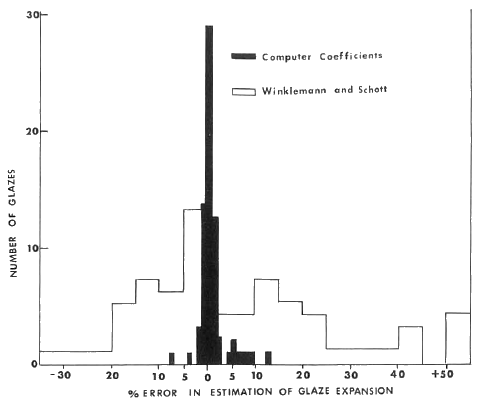
A continuación se da un ejemplo de cálculo del coeficiente de dilatación de un vidriado concreto, así como una estimación del error cometido si lo comparamos con el coeficiente de dilatación real del vidriado medido por métodos experimentales. La fórmula Seger del vidriado es la siguiente:

Y los cálculos necesarios se reproducen a continuación:

Aunque hay un ligero error en el cálculo de la expansión del esmalte mediante este método, resulta muy útil. La revisión del cálculo revela qué óxidos están contribuyendo más a la expansión y cuáles deberían ajustarse para obtener el mayor cambio en la dirección deseada.
Es importante destacar que tales cálculos son válidos solo si todos los componentes del vidriado están en solución en el estado vítreo. Cualquier material cristalino no disuelto anulará dicho cálculo. Vidriados que pueden desarrollar cristales durante el proceso de enfriamiento, como los esmaltes aventurina o mate, tendrán expansiones bastante diferentes a la cifra calculada. A medida que el vidriado madura, hay una reacción en la interfase entre este y el cuerpo cerámico que cambia la composición del vidriado en esta zona. A menudo se desarrollan cristales de mullita en la interfase, lo que alterará el coeficiente de expansión. Los ingredientes que se pierden durante el proceso de fusión por volatilización cambiarán la composición final del vidriado. Los compuestos de boro y flúor son especialmente susceptibles a la volatilización. Sin embargo, tales cálculos son útiles para ajustar la expansión, aunque puedan no ser absolutamente precisos.
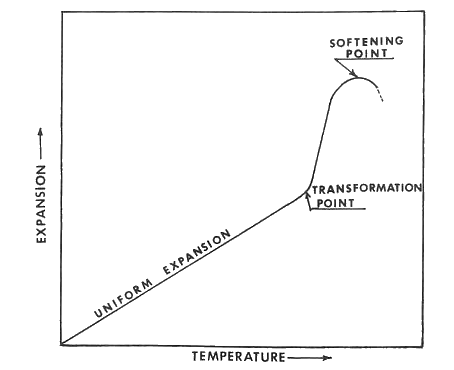
Los vidrios y vidriados tienen curvas de expansión térmica similares a la que se muestra en la figura siguiente. La expansión uniforme ocurre desde la temperatura ambiente hasta el punto T, que se denomina punto de transformación. En este punto, la energía térmica es suficiente para romper algunos enlaces en la estructura del vidrio, debilitándolo. La expansión luego ocurre más rápidamente desde (T) hasta (S). El punto (S) es el punto de reblandecimiento del vidrio. A esta temperatura, la viscosidad es lo suficientemente baja como para permitir el flujo. El vidrio se deformará bajo su propio peso y aliviará inmediatamente cualquier tensión aplicada por deformación.
Viscosidad del vidriado
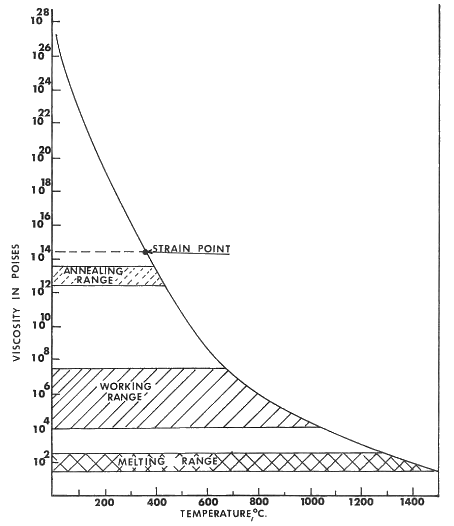
La relación viscosidad-temperatura de un vidriado se muestra en la figura siguiente e ilustra, para un vidrio de sodio-calcio-sílice, el rápido aumento en viscosidad a medida que la temperatura disminuye. Debe recordarse que los vidriados son sistemas mucho más complejos que este vidrio simple ilustrado, ya que contienen muchos más componentes. Las temperaturas a las que se alcanzan viscosidades comparables en un vidriado serán, por lo tanto, mucho más bajas, pero la forma de la curva y las relaciones generales serán las mismas.
Algunos de los puntos de referencia importantes utilizados al discutir la viscosidad de un vidrio son los siguientes:
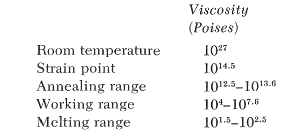
Para fines comparativos, la viscosidad a temperatura ambiente del aceite de ricino es de 10 poises.
Un vidriado se desarrolla en la superficie de la cerámica mediante la fusión de sus componentes en polvo. Las características de expansión desempeñan un papel importante durante el proceso de enfriamiento. El vidriado se contrae uniformemente, como se ilustra en la siguiente figura. A medida que ocurre el enfriamiento después de que el vidriado ha madurado a una temperatura más alta, se alcanzará el punto en el que el vidrio se vuelve esencialmente rígido. Esto se define como el "punto de deformación (strain)" del vidrio. La viscosidad en este punto es de 1014,5 poises. Es la contracción que ocurre por debajo de esta temperatura la que desempeña un papel importante en la adaptación del vidriado. La mayoría de los vidriados alcanzan esta viscosidad en el rango de temperatura de 500-700°C.
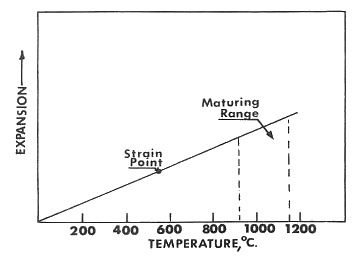
Expansión del cuerpo cerámico
La expansión de un cuerpo cerámico cocido depende de la cantidad, proporciones y composición de las fases cristalinas y vítreas en el cuerpo, así como de la temperatura a la que ha sido cocido. Cada fase cristalina tiene su propio coeficiente de expansión característico. La única manera de determinarlo es midiendo. Como se ejemplifica con la curva de expansión del cuarzo mostrada en la figura siguiente, los materiales cristalinos no siempre tienen una expansión uniforme en un rango de temperatura dado.
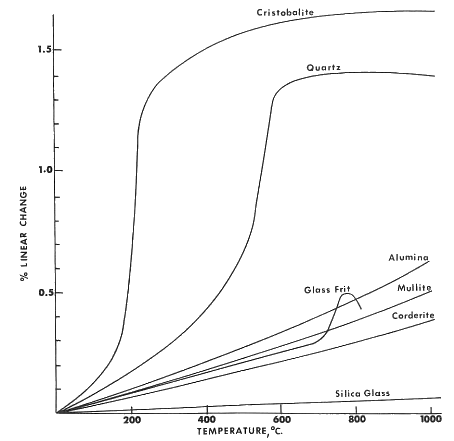
La Tabla 11-2 proporciona los coeficientes de expansión para algunos materiales y cuerpos cerámicos.

La adición de sílice a un cuerpo generalmente aumentará su coeficiente de expansión debido a la alta expansión de las variedades cristalinas de cuarzo y cristobalita. Sin embargo, esto no siempre es el caso. Si hay suficiente vidrio de bajo punto de fusión presente y si la sílice se agrega como un polvo extremadamente fino de tamaño micrométrico, se disolverá en la fase vítrea. Esto resulta en un vidrio altamente silíceo con un bajo coeficiente de expansión. De hecho, este es un método posible para fabricar cuerpos de baja expansión.
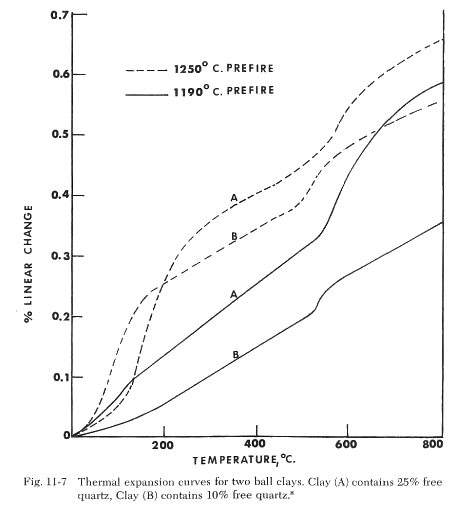
Los cuerpos de gres tienen dilataciones mayores que los cuerpos de porcelana debido a la presencia de cuarzo libre. Las arcillas difieren en la cantidad de cuarzo libre presente y esto afectará la cantidad de expansión del cuerpo cocido. La temperatura y el tiempo de cocción afectan las cantidades relativas de cuarzo y cristobalita formadas y, por lo tanto, la expansión del cuerpo. Estas diferencias han sido demostradas por West en el estudio de reacciones a alta temperatura en arcillas. La figura siguiente muestra algunos de sus resultados. La arcilla (A) es una arcilla de bola que contiene aproximadamente un 25% de cuarzo libre y (B) una arcilla de bola que contiene un 10% de cuarzo libre. Ambas arcillas fueron cocidas a 1250°C y 1190°C, y se midió la expansión térmica. Dos puntos quedan claros en las curvas resultantes de expansión térmica. La inversión de la cristobalita en la región de baja temperatura está ausente en las arcillas cocidas a 1190°C, pero es evidente en aquellas cocidas a 1250°C. Esto corresponde con evidencia previa de que la formación de cristobalita ocurre en la región de 1200°C. Con un aumento del tiempo de meseta a 1250°C., el cuarzo presente podría convertirse completamente en cristobalita y la expansión en la región de baja temperatura se incrementaría, pero se reduciría drásticamente en la región de 573°C. También es evidente que la arcilla con un mayor contenido de cuarzo tiene una mayor expansión térmica, independientemente de la temperatura de cocción previa.
Las propiedades de expansión de un cuerpo de cerámica blanca dependen de su composición. Según la Tabla 11-2, se observa que la expansión del cuerpo que contiene un 7% de feldespato es mayor que la del cuerpo que contiene un 31% de feldespato. En el cuerpo con un 7% de feldespato, la falta de una fase vítrea suficiente para disolver cantidades significativas de sílice hace que la proporción de fase cristalina a vítrea sea alta. Esto resulta en una alta expansión térmica. El cuerpo con un 31% de feldespato tiene una expansión menor porque la fase vítrea ha disuelto cantidades considerables de sílice, reduciendo así la variedad cristalina y aumentando también el contenido de sílice en la fase vítrea, lo que reduce su expansión. El cuerpo con un 49% de feldespato tiene un exceso de vidrio feldespático de alta expansión, con un porcentaje relativamente menor de sílice disuelta. El cuerpo óptimo con un 31% de feldespato tiene el equilibrio correcto entre las fases vítreas y cristalinas, y tiene la expansión más baja.
Interacciones entre el cuerpo y el vidriado
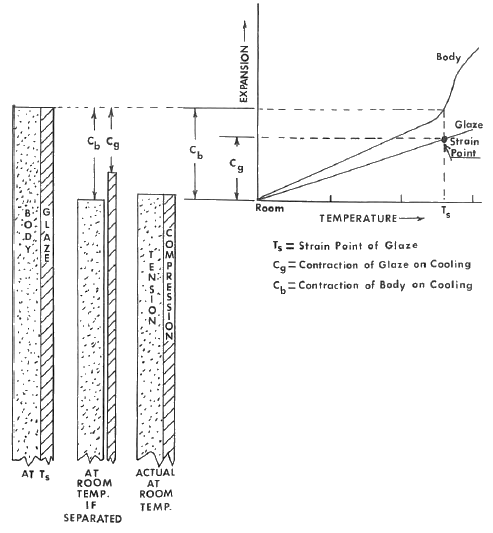
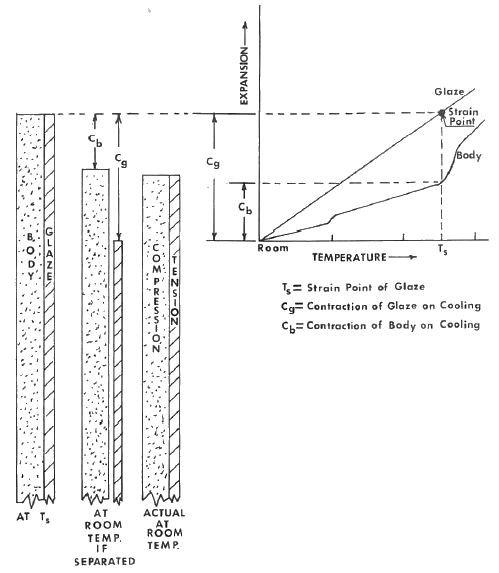
Después de esta breve introducción a las características de expansión de vidriados y cuerpos cerámicos, podemos considerar lo que sucede cuando ambos están en contacto y presumiblemente íntimamente unidos entre sí. Las dos figuras siguientes muestra las relaciones entre las características de expansión térmica de un vidriado y el cuerpo cerámico, y las tensiones de compresión-tensión desarrolladas durante el enfriamiento.
En el ejemplo dado, el vidriado tiene una tasa de expansión más baja que el cuerpo. Al enfriarse desde la temperatura (Ts), la temperatura en la cual el vidriado desarrollará por primera vez tensión, el vidriado se contraería en una cantidad (Cg) y el cuerpo se contraería en una cantidad (Cb), si estuvieran separados. Dado que están unidos, el vidriado debe estar en compresión y el cuerpo en tensión después del enfriamiento. Esta es la condición más deseable y estable.
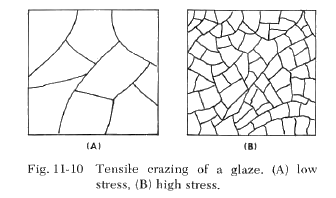
El caso de un vidriado con una tasa de expansión más alta que el cuerpo, se ilustra en la segunda figura. Al enfriarse desde la temperatura (Ts), la temperatura en la cual el vidriado desarrollará por primera vez tensión, el vidriado se contraerá en una cantidad (Cg) y el cuerpo se contraerá en una cantidad (Cb), siempre y cuando estuvieran separados. Dado que están unidos, el vidriado estará en tensión y el cuerpo en compresión. Esta es la condición propicia para la formación de grietas en tracción. Este tipo de patrón de grietas se ilustra en la Figura 11-10. Cuanto mayores sean las tensiones de tracción, más pequeño será el patrón de grietas. Con fines decorativos, el patrón de grietas se puede controlar mediante la manipulación de la diferencia de expansión entre el cuerpo y el vidriado.
Algunos vidriados son más propensos a sufrir craquelado por tracción que otros. Los vidriados mate o cristalinos pueden resistir tensiones de tracción de 15-20,000 psi sin craquelado, debido a la naturaleza reforzante de la fase cristalina.
Cuarteado retardado
Es evidente que si tanto el cuerpo como el vidriado cambian de dimensiones después de alcanzar la temperatura ambiente, la distribución de tensiones también cambiará.
Se ha demostrado que los vidriados pueden seguir contrayéndose durante varios días después de ser cocidos. Esto se debe a que el vidriado no alcanzó condiciones de equilibrio durante el proceso original de enfriamiento. La alta viscosidad del vidriado no permitió que se contrajera tanto como debería haberlo hecho. Por lo tanto, la contracción continúa durante algún tiempo después. Tal contracción resulta en una disminución de la tensión compresiva original y el vidriado puede acabar en tracción y generar grietas. Se ha demostrado que la contracción retardada de un vidriado no es más del 2% de la contracción total. Por lo tanto, este mecanismo no es un factor demasiado grave en el craquelado retardado.
La causa más probable del craquelado retardado es la expansión por humedad del cuerpo cerámico. Esto ocurre especialmente en cuerpos porosos y en cuerpos cocidos a baja temperatura. El vapor de agua entra en el cuerpo y se adsorbe en las superficies internas. Si el cuerpo se cocía en la región de 700-950°C, se encuentra presente metacaolín. Como se indicó anteriormente al discutir los cambios que ocurren cuando se calienta la caolinita, el metacaolín puede reaccionar con el agua a temperatura ambiente y volver a convertirse en caolinita. Acompañando a este cambio hay una considerable expansión. Este tipo de expansión puede ser problemático tanto en la operación inicial de vidriado como en sus efectos posteriores de expansión. La Figura 11-11 ilustra un tipo de defecto que ocurre durante el proceso de aplicación del vidriado debido a la reacción del agua con metacaolín presente en una pieza mal bizcochada. La cerámica que parece satisfactoria inmediatamente después del cocido y que, días o meses después, desarrolla el típico patrón de grietas en tensión, sin duda está absorbiendo humedad y expandiéndose.

La fase vítrea de un cuerpo también está sujeta al ataque por parte del vapor de agua, lo que resulta en la formación de fases cristalinas con un volumen mayor y, como consecuencia, en la expansión del cuerpo. Ciertos vidrios con alto contenido de álcalis son particularmente susceptibles a estas reacciones.
La resistencia al craquelado de un cuerpo vidriado se puede evaluar sometiendo la cerámica a presiones de vapor de 100 psi. Se ha dicho que si una pieza no presenta craquelado después de dos horas a esta presión, no lo hará en 20 años. Desafortunadamente, aunque la prueba de presión de vapor proporciona una buena indicación de la susceptibilidad al craquelado, no siempre predice lo que sucederá en el uso real.
Defectos por compresión
Un exceso de compresión en un vidriado también es indeseable. Esto puede dar lugar a "desprendimiento (shivering)", "pelado (peeling)" o incluso a una fractura completa del cuerpo cerámico. El desprendimiento proviene de que el esmalte está en una compresión suficiente para que el esmalte se separe del cuerpo en la interfaz. Esto se ilustra en la Figura ll-12a.
Si el esmalte está en compresión, el cuerpo estará en tensión. Esta situación suele ser tolerable porque el cuerpo contiene refuerzos en forma de cristales y, por lo tanto, es más resistente en tensión que un vidriado. El cuerpo también tiene una sección transversal más grande que el esmalte para soportar el esfuerzo. Pero si se desarrolla una tensión excesiva en el cuerpo debido a una sobrecompresión del esmalte, el cuerpo puede fallar por excesiva tensión de tracción. Esto es más probable que ocurra en la sección más delgada, la parte más débil, de la pieza. Esto se ilustra en la Figura ll-12c.

Las fallas debidas a una compresión excesiva en el vidriado son más propensas a ocurrir en la interfase entre el vidriado y el cuerpo. Dado que las esquinas o bordes afilados son excelentes puntos de concentración de estrés, la falla suele ocurrir en tales ubicaciones. Este defecto se ilustra en la Figura ll- 12b. Una interfase bien desarrollada entre el vidriado y el cuerpo ayuda considerablemente a reducir tales defectos. La liberación adecuada de burbujas del vidriado fundido, ya que actúan como puntos de concentración de estrés, y una buena reacción entre el vidriado y el cuerpo que desarrolle mullita en la interfase fortalecen la unión entre el cuerpo y el vidriado. Ambos se logran mediante el seguimiento del programa de cocción adecuado y el período de mantenimiento a la temperatura de maduración del vidriado. Los vidriados que maduran por debajo del rango de 1200°C y no desarrollan mullita requieren una atención más cuidadosa respecto a la adaptación del vidriado y son más susceptibles a defectos de compresión.
Prevención del cuarteado
El defecto de craquelado más común es el patrón de cuarteado por tensión de tracción, como se muestra en la Figura 11-10. La solución es aumentar la expansión del cuerpo o disminuir la expansión del vidriado. El remedio más común consiste en agregar sílice al cuerpo (aumenta la expansión) o al vidriado (disminuye la expansión). Aunque parezca incongruente, estos dos remedios alternativos tienen sentido porque la sílice en el cuerpo permanece cristalina y tiene una alta expansión, mientras que la sílice en el vidriado se funde en vidrio y tiene una baja expansión. La reducción de la expansión del vidriado también se puede lograr mediante la adición de B2O3 o la reducción de Na2O o K2O.
Los defectos de compresión requerirían la acción directamente opuesta, es decir, se debe disminuir la expansión del cuerpo o aumentar la del vidriado.
Burbujas
La formación de burbujas es un proceso natural e inevitable en la fusión de los vidriados. Las burbujas proceden tanto del propio vidriado, por la descomposición de las materias primas y generación de sustancias volátiles como el CO2 de los carbonatos o el vapor de agua de las sustancias hidratadas, como de la pasta sobre la que reposa, sobre todo por el aire contenido en los poros. Si los fenómenos que provocan la formación de sustancias volátiles ocurren cuando el vidriado todavía no se ha fundido, no habrá formación de burbujas, ya que los gases podrán salir limpiamente a través de los poros. En cambio, todos los procesos de formación de gases que ocurren una vez que el vidriado se haya fundido, van a producir burbujas en este. El comportamiento de las burbujas en el vidriado tiene mucha relación con la viscosidad del mismo en la fusión. Por ejemplo, muchos vidriados de arcilla con un contenido relativamente alto de alúmina, son muy viscosos en la fusión y se hinchan por la presión de vapor de las burbujas. En cambio, otros vidriados más fluidos dejan escapar las burbujas con facilidad. En la siguiente tabla vemos la temperatura de descomposición de los carbonatos más comúnmente utilizados en los vidriados.

Otras causas que liberan gases durante la cocción son los cambios en la valencia de algunos de los óxidos utilizados como pigmentos, ya sea como consecuencia de la reducción o simplemente a causa del aumento de temperatura, y esta es una razón importante por la cual en la industria se prefiere utilizar fritas u colores procesados (stains). El dióxido de manganeso, por ejemplo, libera oxígeno al transformarse en óxido manganoso (MnO) a 1080ºC y la forma más común de cobalto (Co3O4) se reduce a CoO alrededor de 900ºC. La evidencia de estas transformaciones puede apreciarse a veces en áreas con un rosario de agujerillos que coincide exactamente con la decoración de óxidos bajo cubierta. El cobre, hierro y vanadio son particularmente afectados por la reducción.
En general, casi todos los vidriados necesitan de una meseta al final de la cocción para facilitar la eliminación de las burbujas. En algunos casos, basta con una meseta breve de diez minutos, y en otros son necesarias largas mesetas de hasta una hora o más.
A veces, las burbujas pueden ser un defecto que estropea completamente el vidriado, como sucede en los vidriados transparentes y brillantes, por ejemplo, con el defecto conocido como “puntas de alfiler” (pinholing), pero otras veces las burbujas van a formar parte de la textura superficial que se busca en el vidriado, como en un vidriado “piel de naranja”. Además, las burbujas pueden estar en el interior o en la superficie. Si el vidriado es opaco, las burbujas internas no van a tener ninguna incidencia en el aspecto visual, e incluso pueden ser una ayuda para provocar la opacidad. Las burbujas superficiales, en cambio, suelen ser bastante molestas en casi todos los vidriados.

Calvas o superficies sin cubrir
Hay varias causas por las cuales un vidriado se regoje dejando calvas sobre el soporte, y este defecto se da en mayor o menor grado, por lo que se puede describir con distintas denominaciones (crawling es el término inglés más común, creeping, rolling, beading cuando todo el vidriado se recoge formando pequeñas perlas y curling o butterfly cuando los bordes se curvan despegándose del soporte).

Básicamente, todos los defectos se producen porque el vidriado no se adhiere bien a la superficie del soporte, con frecuencia ya desde que el vidriado se secó sobre el cacharro, en combinación con la viscosidad en estado fundido. Un vidriado fluido se extiende uniformemente sobre toda la superficie del cacharro y será suave incluso en las imperfecciones que hubiese, aunque no estuviesen muy a la vista, antes de la cocción. Los vidriados opacos son especialmente propensos al crawling ya que los opacificantes tienden a hacer más viscosa la fusión.
La capacidad cubriente de un vidriado cuando está fundido se puede comparar con su capacidad para “mojar” y reaccionar con la superficie del soporte formando una “interfase” entre ambos. Este proceso, en realidad, incluye reacciones químicas y cuando ha tenido lugar con suficiente extensión se forma una capa de vidrio entre la pasta y el vidriado, con una composición intermedia entre ambas. Para mejorar las propiedades de la capa de vidriado es importante la formación de una buena interfase y, como en otras reacciones cerámicas, el tiempo ayuda a ello.
Los vidriados que fundidos son demasiado viscosos pueden suavizarse variando la composición. La alúmina, derivada de la arcilla o el feldespato, es la principal culpable, así que debe rebajarse su proporción en caso de falta de fluidez mediante una reducción de dichas materias primas, acompañada de un aumento del cuarzo para compensar la cantidad sustraída. En algunos casos, la proporción de los fundentes menos activos (bario y magnesio) también debe reducirse. La cantidad de opacificante empleado también puede reducirse haciendo cambios en la receta para equilibrar dicha disminución.
Previo a la cocción, hay que considerar un examen de la superficie de la pieza a vidriar antes de aplicarle el vidriado. Es sorprendente la cantidad de polvo que se acumula sobre las piezas bizcochadas, también pueden aparecer granos de chamota, agujeros o defectos que impiden una correcta aplicación de la capa de vidriado. También podría haber grasa superficial por la manipulación, o una porosidad desigual a causa de la fusión parcial bajo vidriado o una decoración con engobe y, en consecuencia, producir un vidriado de grosor desigual y con tensión entre diferentes partes. El resultado de todas estas condiciones podría ser el cuarteado del vidriado en seco.
Lavar el bizcocho y un tratamiento cuidadoso de la superficie puede evitar algunos defectos en la capa de vidriado como, por ejemplo, las calvas. Tras lavar el cacharro habría que secarlo un poco, sin embargo, sobre la cerámica más porosa se aplica mejor el vidriado si el cacharro está húmedo. Las peores calidades superficiales de, por ejemplo, arcillas con chamota, pueden mejorarse cubriendo la superficie con un engobe antes del bizcochado.
Las calvas también pueden ser causadas por la pérdida de muchas sustancias volátiles del vidriado como la materia carbonosa de arcillas o cenizas, el dióxido de carbono y otros gases de los carbonatos etc., y el agua química de arcillas u otros minerales. En estas circunstancias, las sustancias pierden tanto volumen durante las primeras etapas de la cocción que no queda un grosor suficiente para recubrir adecuadamente el cacharro durante la fusión. Estas dificultades pueden evitarse de antemano con una preparación más cuidadosa de los materiales, incluyendo la calcinación de parte de la arcilla del vidriado. Siempre conviene dejar una parte de la arcilla sin calcinar para estabilizar la suspensión del vidriado y también un mejor agarre sobre el bizcocho.
La molienda excesiva es otra causa para que la adherencia de la capa de vidriado sea débil y propensa a dejar calvas. Generalmente, los materiales adquiridos en el comercio ya tienen el tamaño de grano adecuado, aunque a veces se meten al molino para asegurar el perfecto mezclado de los pigmentos. En este aspecto, se ha comprobado que los vidriados Orientales, que tradicionalmente se muelen a mano durante largos periodos (24-28 horas), son propensos a dejar calvas. El remedio es mezclar el pigmento con solo una parte del vidriado. Además, parece comprobado que la existencia de diferentes tamaños de partícula en la capa de vidriado mejora la adhesión y resistencia de este antes de la cocción.
Otro fenómeno que influye el recogimiento del vidriado es la tensión superficial del mismo. Esta es, la tendencia que tienen los líquidos a recogerse en esferas. En un extremo, podemos citar el mercurio, que tiene una elevada tensión superficial, y en el otro la gasolina, que se extiende cubriendo amplias superficies con capas muy finas. En el caso de los vidriados, hay óxidos, sobre todo MgO y Al2O3, que aumentan mucho la tensión superficial del vidriado en la fusión, provocando que se recoja dejando islas de vidriado rodeadas por superficies secas.
Desvitrificación
Este defecto consiste en la formación de cristales en la superficie del vidriado. Sobre todo se considera un defecto en la cerámica industrial, cuando la desvitrificación puede ocasionar que sobre la superficie brillante de una baldosa aparezcan heterogeneidades producidas por las formaciones cristalinas, sin embargo, en cerámica artesanal no suele suponer un problema importante. Algunos óxidos, como el ZnO, favorecen claramente la aparición de cristalizaciones superficiales.
Bibliografía
- Arcilla y vidriado para el ceramista, Daniel Rhodes. Editorial CEAC, 1990
- A handbook of pottery glazes, David Green. Watson-Guptill Publications, 1979
- Ceramic science for the potter, W. G. Lawrence. Chilton Book Company, 1972
- Formulario y prácticas de cerámica, J. LLorens Artigas. Editorial Gustavo Gili, 1961
- Stoneware Glazes. A systematic approach, Ian Currie. Bootstrap Press, 1986
- Manual del ceramista, Bernard leach. Editorial Blume, 1981
- Vidriados cerámicos, Wolf E. Matthes. Editorial Omega, 1990
- The potter's dictionary of materials and techniques, Frank and Janet Hamer. Ed. A&C Black, 2012
- The complete guide to high-fire glazes, John Britt. Ed. Lark Crafts 2007
- Glazes cone 6, Michael bailey. Ed. A&C Black, 2010.