Teoría / Arcilla
Introducción
La arcilla es el resultado del largo proceso de envejecimiento de la corteza terrestre. A través de los siglos las fuerzas naturales como la lluvia, el viento o los glaciares, modifican la superficie rocosa fragmentando y desmenuzando las rocas. Estos fragmentos pueden ser posteriormente transportados por corrientes de agua y combinarse durante el viaje con otras sustancias hasta depositarse finalmente en algún lugar. A lo largo de esta intemperización se forma la arcilla, sustancia que podemos considerar como una mezcla promediada de los componentes de la corteza terrestre molidos hasta la saciedad y completamente mezclados entre sí.
El Diccionario de la Lengua Española, en su vigésima primera edición, define el término arcilla: tierra finamente dividida, constituida por agregados de silicatos de aluminio hidratados, que procede de la descomposición de minerales de aluminio, blanca cuando es pura y con coloraciones diversas según las impurezas que contiene. ||de alfarero. La que, empapada en agua, da color característico, se hace muy plástica, y por calcinación pierde esta propiedad, se contrae y queda permanentemente endurecida. Etimológicamente, la palabra arcilla proviene del latín "argilla" y esta del griego "argos" o "argilos" (=blanco), por el color del material cuando contiene pocas impurezas, usado en cerámica.
El término arcilla es difícil de precisar, pues tiene un significado diferente en edafología (estudio de los suelos), química, petrología y mineralogía, cerámica artística o cerámica industrial. Tampoco tiene un significado genético unitario ya que su origen puede derivar de procesos geológicos diferentes. Conceptualmente, entenderemos la arcilla como producto natural derivado del envejecimiento de la superficie terrestre. En ese sentido, la arcilla es un material muy corriente y puede encontrarse casi en cualquier lugar, otra cosa es que tales arcillas naturales sean adecuadas para un uso concreto. En algunos casos la arcilla que recojamos del campo no tendrá propiedades suficientemente buenas para su aprovechamiento cerámico, en otros, podrá utilizarse después de modificarla en mayor o menor medida, y en las mejores circunstancias, la arcilla será útil tal cual la extraemos del suelo.
En cerámica es común expresar las composiciones de las distintas sustancias como combinación de los óxidos que las componen. La razón es que, durante la cocción, según aumenta la temperatura, las diferentes materias primas, incluyendo la propia arcilla, se descomponen y recombinan siendo los óxidos las unidades básicas de tales descomposiciones y recombinaciones. Además, el oxígeno, que es un elemento muy abundante y reactivo provoca que todo se oxide, es decir, se combine con oxígeno cuando la temperatura se eleva lo suficiente en el horno. Por ejemplo, la caolinita, que es la principal especie mineral del caolín, se representa en la literatura cerámica mediante la fórmula Al2O3·2SiO2·2H2O, a pesar de que en mineralogía o química no es tal la expresión corriente.
El ceramista reconoce la arcilla como un material con una serie de propiedades características. El químico la entiende como una mezcla compleja de minerales, y puede ofrecer su análisis de dos formas: como la composición porcentual de sus óxidos constituyentes, o en función del contenido de arcilla y otros minerales y óxidos. Este último análisis ofrece más información sobre las posibles propiedades de la arcilla. Por ejemplo, una pieza de arcilla de origen glaciar podría expresarse mediante los siguientes análisis:
alúmina 23 contenido de arcilla 50
sílice 62 feldespato 15
óxido de hierro 1 sílice libre 29
óxidos de Ca y Mg 3 óxido de hierro 1
óxidos de K y Na 2 caliza 5
pérdida de cocción 9
El primero de los análisis expresa la composición porcentual en óxidos. La segunda forma, denominada "análisis racional", expresa la composición mineralógica de la arcilla, pero se ha obtenido de forma teórica a partir de la primera y de las propiedades físico-químicas de la arcilla.
En la siguiente imagen podemos comparar la composición media de la corteza terrestre, expresada en forma de óxidos, con la composición de un barro rojo típico que puede utilizarse para torno y modelado.
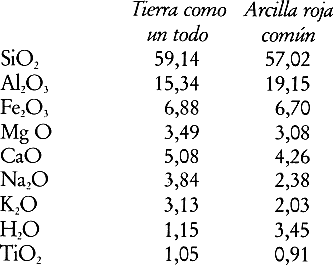
Vemos que las proporciones de los distintos óxidos que aparecen son bastante similares en los dos casos, lo cual, es bastante razonable dada la imagen conceptual que hemos dado de la arcilla como un producto de la descomposición de la corteza terrestre.
Orígenes geológicos de la arcilla
Empezaremos a comprender la arcilla a partir de su origen geológico, para lo cual, antes hay que introducir algunos términos básicos sobre geología. En la corteza terrestre suelen distinguirse tres tipos de rocas: primarias, sedimentarias y metamórficas. Las rocas primarias, igneas o magmáticas son las que solidifican desde el magma líquido primigenio que formaba la Tierra en sus orígenes, y han quedado inalteradas desde entonces, o bien se han formado a partir del magma en una época más reciente. Las rocas sedimentarias son las que se forman a partir de la descomposición de otras rocas o sustancias minerales, sobre todo por los agentes meteorológicos, como en el caso de la intemperización de las arcillas. Por último, las rocas metamórficas son las que se forman a partir de otros tipos de rocas, principalmente por presión tras transformaciones de la corteza. Algunos ejemplos de rocas son el granito, basalto y piedra pómez, que son primarias; la pizarra y el mármol, que son metamórficas; y la arcilla, caliza y arenisca, que son sedimentarias. Después, veremos más cosas sobre las rocas
Las arcillas, en cuanto a su formación, también se clasifican en primarias y secundarias. Las arcillas primarias son las que permanecen en el mismo lugar en el que se han formado por desintegración de sus rocas madre, y las secundarias son las que, tras ese fenómeno inicial de desintegración, son transportadas por el agua o el viento y, a lo largo de ese proceso de transporte, se combinan con otras sustancias, hasta depositarse finalmente formando un yacimiento de arcilla. Como consecuencia del proceso de formación, las arcillas primarias son más puras, pues no se han combinado con otras sustancias, y de tamaño de partícula más grueso. Las arcillas secundarias, al contrario, tienen un tamaño de partícula más fino como consecuencia del largo proceso de molienda sufrido durante el transporte y la separación gradual que de forma natural va depositando primero las partículas de mayor tamaño y, también, contienen mayor cantidad de impurezas. Estas diferencias son de gran importancia para el ceramista ya que, como veremos, el tamaño de partícula influye directamente sobre la plasticidad y así, el caolín, que suele ser una arcilla primaria, es muy poco plástico, en cambio, el barro rojo común, que es arcilla secundaria, es más plástico. También vemos que el barro rojo sigue rojo después de cocido y madura a una temperatura cercana a los 1000ºC mientras que el caolín cuece a un color muy claro y es muy refractario, diferencias que se explican por las impurezas contenidas en el barro rojo y ausentes en el caolín.
Estas diferencias son las más importantes para el ceramista cuando se trata de clasificar las arcillas. Si se trata de hacer una clasificación más profunda desde un punto de vista científico las dificultades son enormes ya que las arcillas están compuestas por diferentes minerales de arcilla a los que se añaden diversas impurezas de diversos tamaños. Casi podría decirse que cada arcilla es diferente y responde a la composición de la zona en la que se ha formado.
Impurezas en las arcillas
La pureza de una arcilla es un concepto bastante ambiguo. Sin embargo, como hay que disponer de algún criterio, aunque no sea perfecto, se suele relacionar la pureza con la ausencia de minerales o componentes distintos de los propios minerales de la arcilla. Los llamados minerales de la arcilla (caolinita, haloisita, ilita, etc.), tal como se hallan generalmente en la naturaleza, tienen composiciones y morfologías que a veces son muy variables, aunque siempre dentro de los límites de la identidad mineralógica. Hay que señalar, además, que en las arcillas naturales coexisten con frecuencia dos o más de estos minerales, a veces en estrechas asociaciones.
El concepto de pureza, desde el punto de vista cerámico, supone la exclusión o ausencia de aquellos componentes que puedan ser indeseables para un fin determinado. No tiene, por tanto, significación absoluta. Por ejemplo, en una arcilla refractaria son indeseables las sustancias o los minerales fundentes, tales como los feldespatos, porque hacen disminuir la temperatura de reblandecimiento del refractario. En una arcilla para fabricar porcelana no son perjudiciales los feldespatos, ya que estos minerales son componentes habituales en las pastas de porcelana y, sin embargo, son indeseables las impurezas coloreadas, tales como los óxidos de hierro o los minerales que los contienen, porque comunican un tinte amarillento o grisáceo a la porcelana, y disminuyen su índice de blancura. En las arcillas para la fabricación de ladrillos no son indeseables los feldespatos porque a las temperaturas habituales de cocción se muestran aún bastante inertes y porque, aunque reaccionaran, el resultado sería beneficioso. Tampoco son indeseables los óxidos coloreados de hierro o de manganeso, porque el color que comunican estos compuestos a los ladrillos es perfectamente aceptado, y porque no inciden negativamente sobre otras propiedades. La caliza en grano grueso, los yesos y los sulfuros, por ejemplo, sí que son indeseables, porque pueden dar origen a defectos tales como caliche y eflorescencia.
Por ejemplo, la operación de lavado de un caolín o de una arcilla tiene como finalidad separar los minerales no arcillosos —los minerales primarios, esencialmente— que, en forma de arenas, están presentes como impurezas. La arcilla o el caolín lavados son, en realidad, concentrados de minerales secundarios.
El blanqueo de los caolines o de las arcillas persigue la eliminación, por medios generalmente químicos, de sustancias coloreadas tales como óxidos más o menos hidratados de hierro, de manganeso y de otros elementos, que están presentes como impurezas, bien en forma de granos separados o bien en forma de películas adheridas a los granos de otros minerales.
La arcilla natural está formada esencialmente por los siguientes componentes:
- Minerales de la arcilla propiamente dichos, de composición a veces muy variable, que incluye sustituciones reticulares de iones que son propios de la red cristalina, e incluso de iones extraños a la misma. También incluye variaciones importantes en la morfología y en la estructura de las partículas arcillosas.
- Formas más o menos hidratadas de sílice, alúmina y óxidos de hierro, de manganeso y de otros elementos.
- Minerales ligeros y pesados en forma de arenas, que a veces llegan a estar presentes como partículas finísimas.
- Carbonatos en diversos grados de dispersión, que abarcan desde la granulometría ultrafina hasta la presencia de concreciones nodulares en las canteras.
- Sales solubles.
- Materia orgánica y residuos carbonosos.
El concepto de pureza en las arcillas, repetimos, tiene solamente una significación relativa y, en muchos casos, incluso, las impurezas dan a las arcillas unas características favorables que hacen aumentar su aprecio. El signo distintivo de muchas arcillas cerámicas, que constituye la razón de su aprecio, está radicado en la naturaleza y en la proporción de sus impurezas.
Al interpretar el análisis químico de una arcilla con vistas a evaluar sus impurezas, hay que tener presente que pequeñas cantidades de un determinado óxido pueden suponer cantidades importantes del mineral considerado como impureza. Así, por ejemplo, si una arcilla tiene la composición química: SiO2, 50.64%; Al2O3, 36.24%; K2O, 1.65%; H2O, 11.47%, la presencia de ese 1,65% de óxido de potasio supone que en la mezcla existe nada menos que un 14% de mica muscovita, de fórmula K2O·3Al2O3·6SiO2·2H2O. Evidentemente, en la composición de la mica muscovita, intervienen, además del óxido de potasio, considerables cantidades de alúmina y de sílice.
Rocas
En este apartado exploraremos las rocas tal como se formaron a partir del magma en la corteza terrestre y cómo fueron cambiando por intemperización. También veremos que, en su formación, las rocas estuvieron sometidas a altas presiones y a temperaturas similares a las que se desarrollan en los hornos cerámicos. Las rocas se componen de minerales con estructura cristalina ordenada.
Los elementos más abundantes de la corteza terrestre son el oxígeno y el silicio, por tanto, es normal que muchas rocas contengan silicatos como, por ejemplo, el feldespato, que es un alumino-silicato, es decir, además de silicio contiene aluminio. Los silicatos podemos dividirlos en dos grupos, los claros y los oscuros. Entre los primeros tenemos el cuarzo y el feldespato, que son los principales constituyentes del granito y se usan bastante en la preparación de pastas y vidriados. Los oscuros tienen hierro y magnesio y ejemplos de ellos son los minerales olivino y piroxeno. Estos componen rocas oscuras como el basalto, constituidos por partículas finas, o el gabro, constituido por partículas más gruesas, y que a veces son utilizados por los alfareros que gustan de componer vidriados con materias primas locales. La estructura de los alumino-silicatos varía dependiendo de su formación. El granito y el basalto son rocas ígneas, formadas por enfriamiento y solidificación del magma, bien a gran profundidad o bien en el flujo de lava de erupciones volcánicas. Según el magma se va enfriando gradualmente, la roca ígnea que se forma a partir de este va cambiando su composición según una variedad de minerales van solidificando, uno tras otro. En el magma cristalizan primero el magnesio, hierro y calcio para formar olivino, de coloración verde oscuro (un grupo de minerales de composición variable entre Fe2SiO4 y Mg2SiO4) y piroxeno (composición entre FeCaSi2O6 y MgCaSi2O6). Estos silicatos ferromagnésicos son más pesados y con punto de fusión más elevado que los más claros de color, aunque una vez que funden son más fluidos. El líquido que queda en el magma es abundante en sodio, potasio y cuarzo, y cristaliza como feldespatos de color claro y cuarzo. Este es más ligero en peso, pero más viscoso, y con frecuencia fluye desde el interior a partir de grandes masas llamadas “plutones” que penetran hacia la superficie a través de grietas entre otras rocas y se llaman “sills” cuando son horizontales y “diques” cuando son verticales. Los silicatos de color claro contienen alrededor del 65% de sílice y son ácidos. Rocas intermedias como la sienita o la diorita contienen menos sílice, 55-65%. Los silicatos más oscuros contienen entre 45-55% y son más alcalinos. La sílice suele clasificarse como óxido ácido a pesar de que no es soluble en agua.
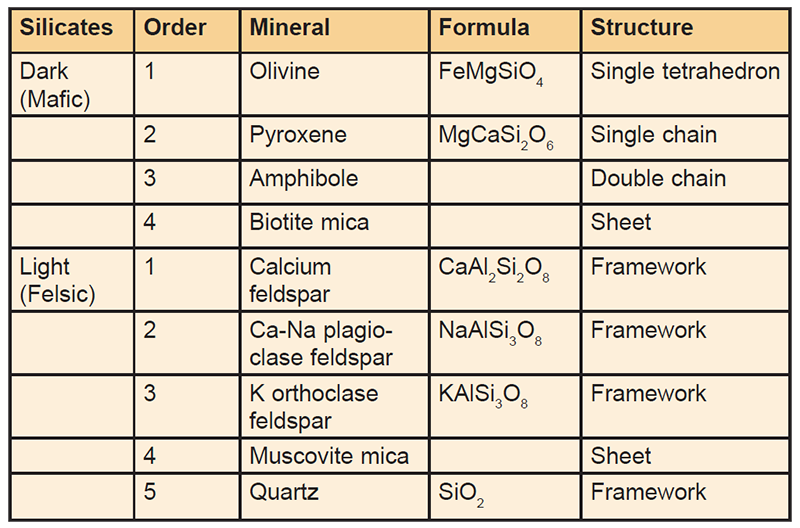
Los minerales más inestables, que se descomponen más fácilmente, son los que tienen una temperatura más elevada de cristalización. Esto es porque forman estructuras cristalinas simples en lugar de otros ordenamientos más estables. El olivino es el menos estable y el cuarzo el más estable entre los silicatos y, por tanto, el más resistente a la intemperización. Los silicatos oscuros se degradan hasta partículas minúsculas, que se encuentran en muchas arcillas como la bentonita, mientras que el cuarzo se encuentra a menudo en cristales grandes. La estructura de la sílice (y todos los silicatos) se basa en un tetraedro (una pirámide de caras triangulares), con un átomo de silicio en el centro y átomos de oxígeno en cada una de las cuatro esquinas. En los silicatos oscuros (máficos) como el olivino, cada tetraedro de sílice aislado se une con magnesio y hierro, en lugar de con otros átomos de silicio. El magnesio y el hierro forman enlaces iónicos, que son menos estables que los enlaces covalentes entre los tetraedros de sílice. Pasando de silicatos más oscuros a más claros, los tetraedros de sílice están unidos en disposiciones cada vez más estables. En el piroxeno, los tetraedros de sílice se unen en cadenas, mientras que en los anfíboles las cadenas se unen para formar cadenas dobles. En las micas biotita y moscovita, los tetraedros de sílice forman láminas enteras. La estructura atómica subyacente se amplía en la estructura cristalina de la mica, que forma placas pseudohexagonales visibles al ojo. La mica se descompone para formar arcilla illítica, que tiene una estructura de lámina similar. En el feldespato y el cuarzo, los tetraedros de sílice están conectados en tres dimensiones para formar un armazón estructural, que es muy estable. En el feldespato, uno de cada cuatro átomos de silicio es reemplazado por aluminio y los espacios más grandes en la estructura se llenan con átomos de sodio o potasio. La diferencia en la valencia entre el silicio y el aluminio se compensa con el sodio o el potasio. En el próximo apartado comenzaremos a ver con más detalle la estructura química de las sustancias, para poder comprender mejor las formaciones mencionadas en este párrafo.
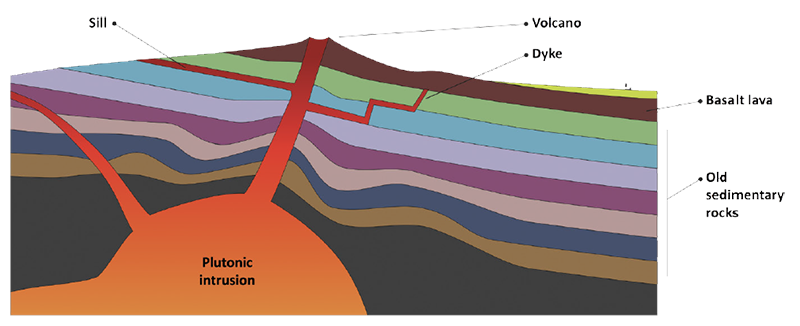
Como dijimos, las rocas se pueden clasificar en tres tipos: ígneas, metamórficas y sedimentarias. Las rocas ígneas son aquellas que se forman a partir de magma enfriado. Si la roca fundida se enfría lentamente en las profundidades de la superficie de la tierra, el tamaño del cristal será grande y de grano grueso. Esto se conoce como roca plutónica o intrusiva, ya que a menudo se encuentran en diques que se introducen en otras rocas. Si los cristales minerales son muy grandes (más de 2 cm), la roca puede ser una pegmatita y algunos tipos contienen feldespatos útiles para los alfareros. Si el magma se enfría rápidamente en la superficie de la tierra, los cristales serán mucho más pequeños y la roca tendrá un tamaño de grano más fino. Este tipo de roca se conoce como volcánica o extrusiva e incluye riolita ligera y basalto oscuro, formado a partir de lava enfriada. Las rocas que son erupcionadas por los volcanes pueden enfriarse muy rápido e incluyen piedra pómez espumosa, basalto vesicular y obsidiana vítrea. Las rocas ígneas más útiles para los alfareros son félsicas, produciendo feldespatos y sílice, que se encuentran junto con la mica en agregados de roca como el granito. La mica es un mineral lustroso, un silicato laminar según vimos, que forma cristales delgados, planos y hexagonales. Existen varios tipos de mica, incluida la moscovita plateada, la biotita oscura y la lepidolita púrpura.

Las rocas metamórficas son aquellas que han sido transformadas por el calor o la presión. Por ejemplo, bajo presión, la arcilla se convierte en pizarra y la piedra caliza se convierte en mármol. Presiones más extremas pueden dar lugar a rocas metamórficas como el gneis y el esquisto, que tienen estructuras en bandas, con plieges o en capas. El talco, un silicato de magnesio comúnmente utilizado en los esmaltes, forma un tipo de esquisto conocido como alabastro o esteatita bajo presión.
Con el tiempo, las rocas son llevadas a la superficie por los movimientos de la tierra y erosionadas, descompuestas y transportadas por glaciares, ríos y el viento y depositadas en lagos y estuarios como sedimentos. Las rocas sedimentarias incluyen arenisca, piedra caliza y tiza, que se formó a partir de capas de conchas fósiles y plancton depositados en cálidos mares del Cretácico durante millones de años (creta es tiza en latín). Incrustados en la tiza hay nódulos de sílex, que se cree que se derivan de antiguas esponjas silíceas. La mayoría de las arcillas son también depósitos sedimentarios, compuestos de granitos erosionados. Cuando la arcilla se cubre con sedimentos nuevos y se comprime durante millones de años, gradualmente se convierte en lutita (esquisto arcilloso). Cuando la lutita se comprime y se calienta, se transforma en pizarra. Las rocas se reciclan continuamente, de modo que las lutitas antiguas son erosionadas y transportadas para producir nuevas capas de arcilla sedimentaria. La lutita también se puede volver a convertir en arcilla plástica triturando y mezclando con agua.
En los siguientes párrafos introduciremos algunos conceptos químicos sencillos con el fin de comprender mejor las estructuras de las sustancias mencionadas en este apartado.

Los electrones y el enlace químico
Casi todos los fenómenos que vemos pueden explicarse a partir del intercambio de electrones, en particular, uno de los más importantes es el enlace químico. En esta sección vamos a introducir la estructura del átomo y el enlace químico, de manera muy elemental, para pasar a explicar en secciones posteriores la estructura cristalina de los minerales de arcilla.
El átomo es la partícula más pequeña que conserva propiedades individuales distintivas, de modo que existen muchos átomos distintos entre sí. Estos aparecen ordenados en la tabla periódica de los elementos. Lo que caracteriza cada átomo son sus partículas constituyentes, y estas pueden ser de tres tipos: protones, neutrones y electrones. Los protones y neutrones conforman el núcleo de átomo, donde se concentra casi toda la masa del mismo, y los electrones están en el exterior del núcleo y tienen una masa unas 2000 veces menor que la de protones y neutrones, que tienen la misma. Los electrones y protones tienen carga eléctrica, y esta característica es la responsable del enlace químico y de un sinfín de propiedades más. Por convención, la carga del electrón es negativa y la del protón positiva, y ambas tienen la misma magnitud absoluta. El neutrón no tiene carga eléctrica. En principio, los átomos son neutros en cuanto a la carga eléctrica porque tienen el mismo número de protones y electrones, aunque es posible que un átomo gane o pierda electrones, en cuyo caso se conoce como "ion". Si gana electrones será un ion negativo o "anión" y si los pierde será positivo o "catión".
La estructura electrónica de los átomos, es decir, cómo se disponen los electrones alrededor del núcleo del átomo y las modificaciones de dicha estructura cuando un átomo gana o pierde electrones se conocen bastante bien gracias a la física cuántica, pero son cosas que quedan fuera de estos apuntes. Sin embargo, sí es útil saber que la estructura electrónica es más o menos estable según la cantidad de electrones que haya en la zona más alejada de la influencia del núcleo atómico. Aquí conviene recordar que como toda la carga positiva del átomo se encuentra en el núcleo y toda la carga negativa está en los electrones alrededor del núcleo, y las cargas de signo opuesto se atraen entre sí, los electrones están ligados al núcleo por potentes fuerzas electromagnéticas, si bien, cuanto más alejados están los electrones del núcleo menor es la fuerza de atracción que este ejerce. En una versión simplificada, podríamos decir que la estructura electrónica tiene una estabilidad máxima cuando hay ocho electrones en la zona más alejada del núcleo y, a partir de esta sencilla hipótesis podemos elaborar una teoría básica del enlace químico. Llamaremos a este grupo de electrones que se sitúan en la zona más alejada del núcleo "la última capa".
Cuando un átomo tiene ocho electrones en la última capa su estructura electrónica es estable y el átomo no reacciona químicamente, es decir, no forma enlaces. Estos son los únicos átomos aislados (no se combinan con otros) que existen y se conocen como "gases nobles". Pertenecen a este grupo, por ejemplo, el helio y el neón. En cambio, cuando los átomos tienen seis o siete electrones en la última capa se dice que son muy "electronegativos", ya que buscan con avidez más electrones para llegar a tener la última capa completa con ocho electrones. Ejemplos de átomos de este tipo son el cloro, que tiene siete electrones en la última capa, y el oxígeno, que tiene seis. Por otra parte, hay átomos que solo tienen uno o dos electrones en la última capa, y se desprenden de ellos con facilidad para quedarse con la siguiente capa completa, por lo que se les llama átomos "electropositivos". Ejemplos son el sodio o el hidrógeno, con un solo átomo en la última capa, o el calcio, con dos electrones. Podemos imaginar, que si se junta un átomo muy electronegativo con otro muy electropositivo, el primero le va a quitar su electrón al segundo, por lo que se van a formar dos iones, uno positivo y el otro negativo. Además, como estos iones tienen cargas opuestas, se van a atraer entre sí. Así es como se forma el enlace iónico, que es el enlace químico que se forma por atracción electromagnética entre iones. Un ejemplo de este tipo de enlace es la sal común o cloruro sódico, ClNa, en el que el átomo electropositivo de sodio le cede su electrón al átomo electronegativo de cloro formándose dos iones de cargas opuestas que se mantienen ligados por la atracción de las cargas opuestas. Un pequeño grano de sal contiene una barbaridad de millones de estos iones unidos entre sí formando una estructura ordenada o estructura cristalina. Otras veces, los átomos no se birlan los electrones entre sí, sino que los comparten. Por ejemplo, todas las moléculas diatómicas que forman la atmósfera, como el O2 o el N2, se forman por este tipo de enlace, llamado enlace covalente. Hay otro tipo de enlace, denominado enlace metálico, cuya explicación es algo más compleja y no vamos a verla, pero es característico de los metales, en los que hay una nube de electrones libres, que no están ligados a átomos concretos sino que tienen cierta libertad para moverse por la red cristalina y, precisamente por ello, los metales son buenos conductores de la electricidad. Finalmente, hay otro hecho destacable en relación con los enlaces que tiene que ver con el fenómeno conocido como polaridad. Lo vamos a ver con el ejemplo de la molécula de agua.
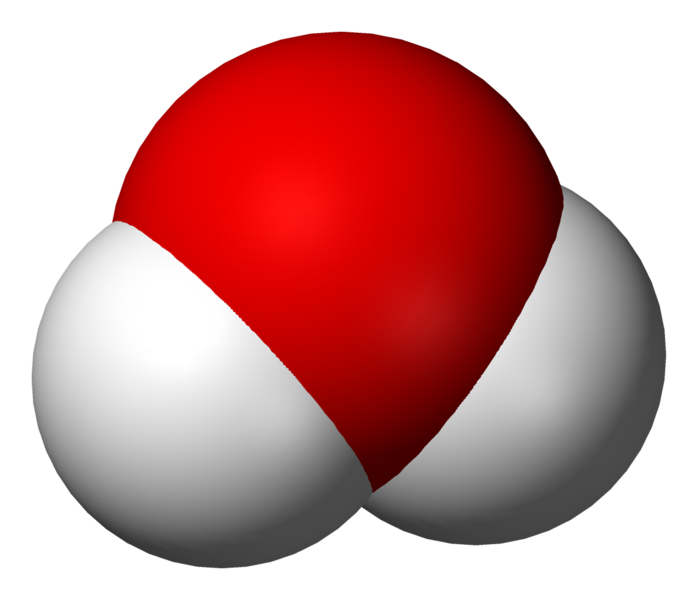
El diagrama representa una molécula de agua, H2O, en la que la zona roja corresponde al átomo de oxígeno y las zonas blancas corresponden a los átomos de hidrógeno. La zona roja tiene carga negativa porque el átomo de oxígeno es electronegativo, y las zonas blancas tienen carga positiva porque el átomo de hidrógeno es electropositivo. Por esta asimetría en la distribución de la carga, se dice que la molécula de agua es polar. Este desplazamiento de las cargas en la molécula provoca que haya fuerzas de interacción con otras moléculas también polares, lo cual explica ciertos fenómenos de orientación y enlace que suceden en este tipo de moléculas.
Acabo este apartado remarcando que una representación como la que vemos más arriba para la molécula de agua se conoce como modelo de esferas, y se utiliza mucho para representar las estructuras cristalinas de los sólidos iónicos o, en general, para cualquier sistema formado a partir de enlaces de tipo iónico. El tamaño de cada esfera viene determinado por el llamado radio iónico, que puede determinarse experimentalmente para cada elemento químico. Volveremos sobre este modelo de esferas para explicar la estructura de los minerales de arcilla.
Estructura química
Si volvemos sobre la composición media de la corteza terrestre, que mencionamos en un apartado anterior, vemos que la sílice (SiO2) da cuenta del 60% del material. La sílice pura es una mínima parte de esa cantidad (el cuarzo y los minerales relacionados), sin embargo, el silicio da origen a la extensa familia de los silicatos que representan más del 95% en peso de la corteza terrestre. La arcilla también es un silicato o, más concretamente, un silicato de aluminio hidratado. Dentro de la familia de los silicatos, la arcilla se clasifica en el grupo de los filosilicatos o silicatos laminares.
El silicio, colocado bajo el carbono en la tabla periódica, es un elemento importante. Si el carbono, gracias a la facilidad que tiene para unirse consigo mismo y con otros elementos da lugar a toda la química orgánica y hace posible la vida, el silicio tiene una función similar dentro de la química inorgánica. Sin embargo, el silicio no se une consigo mismo sino con el oxígeno, de manera que la unidad estructural básica de los silicatos es el tetraedro, formado por un átomo de silicio y cuatro de oxígeno, con el silicio en el centro y los átomos de oxígeno en los vértices del tetraedro, como vemos en la siguiente imagen.
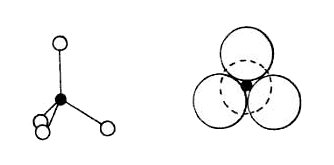
Los silicatos más sencillos son los ortosilicatos, compuestos por la unión del anión [SiO4]4- con cationes. Un ejemplo de ortosilicato es el olivino, compuesto aproximadamente por un 85% de ortosilicato de magnesio y aproximadamente un 10% de ortosilicato de hierro. Por otra parte, si dos unidades [SiO4]4- se asocian compartiendo uno de los oxígenos vértice del tetraedro, tendríamos la unidad [Si2O7]6-, que es rara y no aparece en materiales de interés cerámico. Entre los compuestos cíclicos posibles uniendo varios tetraedros entre sí, el [Si3O9]6- aparece en la wollastonita, y el [Si6O18]12- en el berilo. El siguiente grado de complejidad son los silicatos de cadena, en los que las unidades SiO4 se unen formando largas cadenas. Si las cadenas son sencillas, la composición es (SiO3)n, un ejemplo del cual es el espodúmeno. Compartiendo tres de los cuatro átomos de oxígeno de la unidad SiO4 pueden formarse láminas de silicio-oxígeno. Cuando dicha lámina se compone de anillos de seis silicios, como vemos en el dibujo, tenemos micas y minerales de arcilla, cuya estructura veremos con más detalle. Finalmente, la red tridimensional (SiO2)n se halla en la sílice pura y también en los feldespatos.
Cristaloquímica
Antes de ver la estructura de la caolinita, que es compleja, introducimos algunos principios generales de cristaloquímica que nos ayuden a entenderla.
Una red cristalina está constituida por un gran número de átomos o iones. Para que esta red sea estable, los iones deben estar agrupados muy fuertemente y retenidos en posiciones más o menos rígidas en el espacio por las otras unidades que lo rodean. Debido a que la mayoría de los cristales inorgánicos contienen alguna porción de enlaces iónicos en sus uniones interatómicas, se concibe la red cristalina como constituida por agrupaciones de iones cargados positiva o negativamente y distribuidos de acuerdo a ciertos principios. Estos iones se pueden considerar como esferas rígidas que al apilarse forman diferentes estructuras.
El número de coordinación se puede definir como "el número de iones de carga opuesta que rodea un ión determinado". Los tipos de coordinación tetraédrica y octaédrica (rodeado por seis) son dominantes en la mayoría de las estructuras de los silicatos y particularmente de los filosilicatos. Que sean justamente éstas y no otras coordinaciones las prevalecientes, es una consecuencia del tamaño que tienen los átomos de oxígeno, silicio y aluminio, elementos esenciales en la arquitectura de los silicatos.
Las configuraciones que cabría esperar para varias combinaciones catión/anión, determinadas por las relaciones de los radios, serían las siguientes:
- Coordinación de orden tres, con tres aniones en los vértices de un triángulo equilátero, por ejemplo, en el boro.
- Coordinación de orden cuatro, con cuatro aniones situados en los vértices de un tetraedro, por ejemplo, el silicio, berilio y aluminio. Este último es importante en las coordinaciones tetraédricas de los silicatos, cuando parte del silicio ha sido sustituido por aluminio.
- Coordinación de orden seis, con seis aniones situados en los vértices de un octaedro, por ejemplo, el aluminio, hierro, magnesio, litio y calcio (en casos limitados).
- Coordinaciones mayores, de orden siete a doce como, por ejemplo, elementos como sodio, potasio y calcio.
De la consideración anterior es claro que las configuraciones tetraédricas y octaédricas son comunes en la estructura de los filosilicatos formados a partir de oxígeno, hidroxilos, silicio, aluminio, magnesio, hierro, calcio y otros cationes. Debe tenerse presente que no siempre hay suficientes aniones disponibles para que un catión pueda formar grupos de coordinación independientes. Tal dificultad se supera, generalmente, mediante la participación colectiva de los aniones en la constitución de dos o más grupos adyacentes.
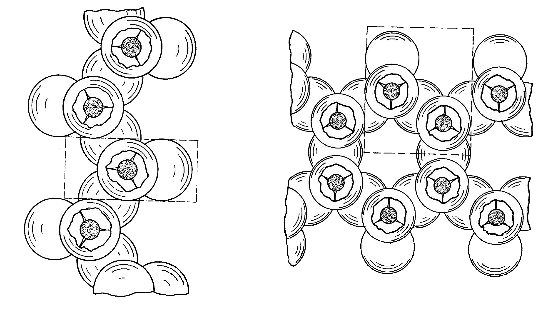
El concepto de "celda unitaria" es importante en cristalografía. Representa una unidad geométrica mínima que mediante repetición, como un ladrillo, puede reproducir el cristal completo. El concepto de celda unitaria es ligeramente diferente en los filosilicatos. En estos minerales la combinación de una hoja octaédrica de alúmina o magnesia con oxígenos e hidroxilos y una o dos hojas tetraédricas de silicio con oxígeno se conoce con el nombre de capa unitaria. La mayoría de los minerales de arcilla constan de estas capas unitarias apiladas paralelamente unas con otras. Dentro de cada capa unitaria, cierta unidad estructural se repite a sí misma en dirección lateral y, para simplificarlo, esta unidad se llama celda unitaria. Cristalográficarnente definida, esta celda se extiende desde un plano en una de las capas unitarias hasta el plano correspondiente en otra capa paralela a la anterior. Una disposición de esta naturaleza puede verse en la figura.
Otros conceptos comunes son los siguientes: Isomorfismo. Se llama así el fenómeno según el cual substancias que, aunque tengan composición química diferente, desarrollan cristales que tienen forma y estructura similar. Se dice que se trata de substancias isoestructurales. El isomorfismo se presenta con bastante frecuencia entre los filosilicatos, que desarrollan series isomorfas entre dos términos de composición diferente: montmorilonita-beidellita, beidellita-montronita,etc. También se presentan series isomorfas entre silicatos y germanatos.
Polimorfismo. Se llama así al fenómeno según el cual una substancia química produce diferentes formas cristalinas. Aunque la composición de los polimorfos es igual, sus propiedades físicas son diferentes. Una modificación polimórfica resulta de cambios en las condiciones, tales como temperatura o presión en el momento de la cristalización de las partículas unitarias (átomos, iones o moléculas), de modo que adoptan una distribución diferente. Un ejemplo lo constituye la calcita (CaCO3) que cristaliza en el sistema romboédrico y el aragonito (CaCO3) que lo hace en el rómbico. El cuarzo (SiO2) tiene dos variedades polimórficas, la tridimita que es hexagonal y la cristobalita que es cúbica. El cuarzo mismo es trigonal con caras romboédricas. Cuando el polimorfismo se presenta en un sólo elemento, se llama alotropía. Ejemplos son el azufre, que puede cristalizar en el sistema rómbico o monoclínico, y el oxigeno (O2) y el ozono (O3) que son formas alotrópicas del mismo elemento. También son conocidos los estados alotrópicos del fósforo.
Politipismo es una forma especial de polimorfismo. La modificación de la estructura implica una diferencia en la distribución del apilamiento de láminas o capas idénticas. Es un fenómeno frecuente en la mayoría de los filosilicatos, tales como micas, caolines, cloritas etc.
Sustitución isomórfica o diadócica. Es poco frecuente que se presenten minerales puros en la naturaleza. Por lo general uno o más iones son sustituidos en cierta proporción por otros iones, siendo los reemplazos esencialmente catiónicos. Conocido es el ejemplo de la dolomita, una caliza magnésica similar a la calcita (CaCO3), pero con algunos iones Mg reemplazando a iones Ca. Tal sustitución de un ión por otro en un cristal, conservando la misma estructura, es lo que se llama reemplazamiento isomórfico. La sustitución isomórfica ocurre con mucha frecuencia en los silicatos y otros minerales que no muestran constancia en la composición química y puede ser parcial o completa. En general, un ión puede sustituir a otro cuando sus radios iónicos difieren en menos de un 15%. Los cationes sustituyen a otros cationes, pero aniones como OH-, y F- y otros podrían entrar a la estructura de un mineral para sustituir oxígeno. Algunos reemplazos frecuentes en filosilicatos son el de Mg por Ca (siempre que éste tenga número de coordinación seis), Fe3+ por Al o Fe2+ por Mg. Tales sustituciones no modifican el balance eléctrico. Frecuentemente un catión de valencia menor reemplaza a otro de mayor valencia, lo cual altera el balance eléctrico y debe ser compensado por introducción de cationes adicionales. Si el Al33+ sustituye al Si4+, debe compensarse una unidad de valencia positiva. Es el caso de los feldespatos, donde algunos iónes silicios están reemplazados por aluminio, y se introduce potasio o sodio para lograr la electroneutralidad. Debe señalarse, finalmente, que los reemplazos isomórficos en los silicatos se producen en el momento de su génesis. Una vez formados, el reemplazo de un ión es un proceso muy lento. No debe confundirse una sustitución diadócica con el intercambio de iones, que es un fenómeno esencialmente externo.
La caolinita desordenada es un mineral de arcilla que ha sido sometido a sustitución isomorfa. La composición, en consecuencia, ya no coincide con la fórmula ideal Al2O3•2SiO2•2H2O. En lugar de ésta, alrededor de uno de cada diez átomos de aluminio se sustituyen por hierro o, en menor medida, titanio; y alrededor de uno de cada cincuenta átomos de silicio se sustituyen por aluminios. La falta de equilibrio resultante se compensa por magnesio u otros átomos divalentes que se acoplan en los huecos de la capa de sílice.
El cristal de caolinita desordenada está distorsionado y, en consecuencia, no es tan compacto como otros cristales de la misma especie. El resultado neto es una estructura más débil, no solo en el interior del cristal, sino también en las partículas del mineral. A diferencia de la caolinita ordenada, que forma grandes partículas de formas regulares, la caolinita desordenada presenta formas y agregados bastante aleatorios. El agua de la intemperie puede penetrar más fácilmente en su estructura para romperla hasta una tamaño muy fino que forma arcillas muy plásticas.
Las caolinitas desordenadas, sometidas al proceso de intemperización y transporte forman algunas arcillas muy plásticas como, por ejemplo, la arcilla de bolas. En cambio, las arcillas compuestas por caolinita ordenada, de cristales muy resistentes, son de naturaleza menos plástica y más refractaria.
Estructura de la caolinita
Los filosilicatos están constituidos esencialmente por redes de iones oxígeno, hidroxilos (el ion hidroxilo es OH-. Puede verse un ejemplo en la estructura de la caolinita en la gráfica de la página anterior) y cationes metálicos. Una consecuencia de las diferencias de tamaño entre los aniones, más grandes, y los cationes, más pequeños, es que estos últimos deben ocupar las cavidades dejadas por la agrupación de aniones. Dependiendo de cómo se unan, se formarán planos estructurales característicos. En los filosilicatos existen dos distribuciones posibles aplicables, una a los iones oxígeno-hidroxilos e hidroxilos, y otra sólo a los oxigenos. Para ello debe admitirse la idealización de considerar que tanto el ión oxígeno como los hidroxilos constituyen esferas rígidas no deformables. Los oxígenos-hidroxilos se disponen en líneas paralelas de manera que tres de ellos forman un triángulo equilátero. Tal ordenamiento, como se ve en la figura, constituye un agrupamiento compacto de esferas en contacto y se aplica tanto a los planos compactos de oxigeno-hidroxilo como a los planos de hidroxilos de los filosilicatos.

El segundo agrupamiento aplicable sólo a los iones oxígeno se logra, geométricamente, retirando desde un plano compacto una esfera de cada dos en hileras alternadas. Se obtienen así cavidades limitadas por seis esferas cuyos centros al unirse forman un hexágono regular y por ello se llama "plano hexagonal de oxígenos", como se ve en la figura.

La superposición de estos planos permite que los elementos de dos de ellos, planos compacto-hexagonal y plano compacto-compacto, puedan formar elementos de cuatro o seis esferas, cuyos centros son vértices de tetraedros u octaedros, respectivamente. El radio de la esfera máxima que puede colocarse en el espacio disponible dejado por los átomos en agrupación tetraédrica es de r = 0,225R Y el de la agrupación octaédrica es r = 0,414R, siendo R el radio del anión. Y puesto que la esfera de referencia corresponde a iones oxígeno (r =1,40Å), el espacio tetraédrico permite alojar un catión de un radio próximo a 0,315Å y el espacio octaédrico a un catión de radio próximo a 0,579Å, que se aproximan a los radios del silicio (0,39Å) y del aluminio (0,55Å) respectivamente.
Al superponer dos planos compactos de tal manera que tres esferas en disposición equilátera del plano superior cubran tres del plano inferior, estando los vértices de ambos triángulos en posiciones opuestas, se obtienen octaedros (figura b). Al superponer dos planos iónicos, uno hexagonal (oxígenos) y otro compacto (oxígeno-hidroxilos o hidroxilos), de modo que el centro de la cavidad dejada por tres esferas basales quede cubierto por una esfera del plano superior, se obtienen tetraedros (figura a).
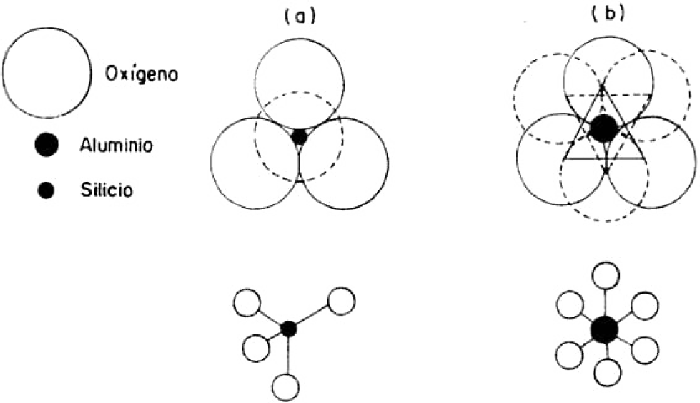
La estructura de los filosilicatos se forma, en consecuencia, por apilamiento de planos hexagonales y compactos. Los grupos principales de los filosilicatos se caracterizan por tener un número constante de dichos planos.
Una terminología específica para describir la estructura cristalina de los minerales evitando las ambigüedades o confusiones que implica el uso indiscriminado de términos tales como "plano", "hoja" o "capa", es la siguiente:
Plano de átomos: una distribución plana de un grosor atómico. Por ejemplo el plano basal de átomos de oxígeno en una hoja tetraédrica.
Hoja de átomos: una distribución plana de un grosor mayor que un átomo y compuesta de uno o más niveles de poliedros de coordinación unidos. Una hoja es más gruesa que un plano y más delgada que una capa. Por ejemplo una hoja tetraédrica, una hoja octaédrica.
Capa: es una combinación de hojas, en una relación 1:1 o 2:1.
Entrecapa: materiales situados entre las capas incluyendo cationes, cationes hidratados, moléculas orgánicas y grupos u hojas de hidróxidos.
Red (específicamente una red de puntos en el espacio): un entramado tridimensional de líneas que conectan los puntos que representan los centros de los elementos estructurales (átomos o iones) en el cristal.
Criterios cristalográficos de los filosilicatos. Los cristales son distribuciones periódicas de una unidad representativa, un grupo de átomos o moleculas, a intervalos regulares en el espacio. Esta unidad representativa es la que conduce a la definición de la red elemental o celda unitaria, que es el volumen más pequeño que puede exhibir todas las características del cristal, siendo la fórmula química la expresión simple de su composición. Por traslaciones repetidas de esta celda en las tres direcciones del espacio, puede derivarse la red completa. Debe escogerse la celda que mejor represente la simetría del cristal.
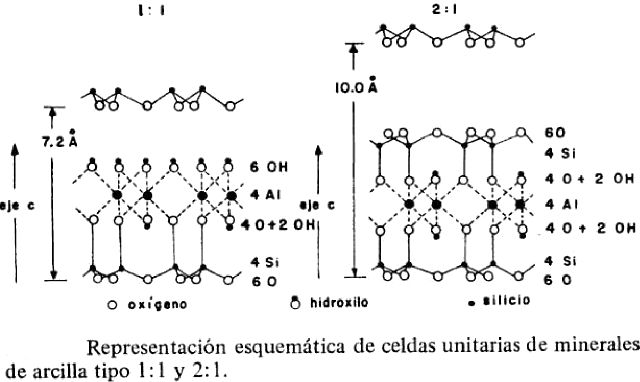
Los minerales de arcilla están constituidos por combinaciones, en diferente proporción, de hojas tetraédricas y octaédricas en relación 1: 1 en las kanditas, 2: 1 en las esmectitas, vermiculitas y micas y 2: 2 en las cloritas. Tales combinaciones de hojas constituyen lo que se llama una capa unitaria. La mayoría de los minerales de arcilla consisten en estas capas apiladas paralelamente unas sobre otras. En cada capa unitaria hay una unidad de estructura que se repite a sí misma en sentido lateral, aunque cristalograficamente la celda unitaria se extiende desde un plano, en la capa unitaria, al plano correspondiente en otra capa unitaria paralela del cristal.
En volumen, los minerales de arcilla son agrupaciones de aniones, formados por apilamiento de tres, cuatro o seis planos de oxígenos o hidroxilos, como ocurre en las kanditas, esmectitas y cloritas respectivamente, y cada uno de estos apilamientos es un componente estable que puede existir en forma independiente de los otros y constituye una capa elemental. Las fuerzas que asocian los constituyentes de estas capas (cationes, oxígenos e hidroxilos) son de naturaleza iónica-covalente, de manera que el conjunto es muy estable. Por el contrario, las fuerzas intermoleculares que unen capas sucesivas, fuerzas de van der Waals y enlaces de hidrógeno son mucho menos intensas, hecho que permite separar las diferentes capas como las páginas de un libro. Bajo la acción de ciertos tratamientos puede constatarse que, en algunos minerales micáceos (muscovita, biotita, flogopita y otros) las capas pueden separarse unas de otras, y se dice que se exfolian.
En la caolinita, por ejemplo, la capa elemental está formada por tres planos: uno hexagonal de oxígenos, otro compacto de oxígenos e hidroxilos y otro compacto de hidroxilos. En la cavidad tetraédrica se alojan silicios y en la octaédrica aluminios. Trazando las celdas elementales en cada plano y contando sus componentes, se encuentra que el plano hexagonal tiene seis oxígenos y cuatro silicios; que el plano compacto siguiente tiene cuatro oxígenos, dos hidroxilos y cuatro aluminios, mientras que el último plano está constituido por seis hidroxilos. Sumando todos estos elementos y expresándolos en forma de óxidos se obtiene, para la celda unitaria, una composición de 4SiO2, 2Al2O3 y 4H2O, la cual corresponde al doble de la fórmula usual de la caolinita, que es 2SiO2·Al2O3·2H2O o Al2Si2O5(OH)4.
El departamento de edafología de la Universidad de Granada tiene una web en la que se explica, mediante modelos de bolas rígidas, la estructura de los filosilicatos. Puede consultarse aquí

Plasticidad de la arcilla
En las secciones anteriores hemos tratado la estructura y propiedadas químicas de la arcilla. En esta sección nos ocuparemos de la propiedad física más importante de la arcilla: su plasticidad.
Ninguna de las definiciones dadas para este término puede considerarse totalmente adecuada, lo cual no es de extrañar, ya que esta propiedad se debe a un complejo y oscuro mecanismo en el que intervienen numerosos factores, y mal se puede definir un fenómeno si no se conoce la verdadera esencia del mismo.
Podríamos hacer un intento de definición diciendo que la plasticidad es la capacidad que tienen algunos materiales para modificar su forma por acción de una fuerza exterior, subsistiendo tal deformación después de cesar la causa que la produjo. Cualitativamente podemos, pues, comparar la plasticidad con la maleabilidad de los metales.
En el aspecto tecnológico, la plasticidad es una de las propiedades más importantes de muchos materiales, hasta el punto de que la utilidad de los mismos viene frecuentemente condicionada a esta cualidad. Prueba de su importancia es que el término plástico ha alcanzado la categoría de ser elegido como título genérico de esa gran familia de materiales que son las macromoléculas de síntesis, cuyas innumerables aplicaciones se deben a su aptitud para ser fácilmente moldeados.
A. B. Searle y R. W. Grimshaw clasifican los materiales plásticos en dos amplios grupos :
- Sustancias homogéneas formadas por una sola fase cuyas propiedades plásticas se modifican por alteración de su temperatura o de su presión. Así, el vidrio, la cera, el lacre y otros muchos materiales se vuelven plásticos en el intervalo de temperatura comprendido entre su punto de reblandecimiento y el de fusión. Esta plasticidad es muy parecida a la viscosidad de los líquidos. Otras sustancias, como el caucho, son plásticas en frío y se vuelven rígidas cuando se calientan mezcladas con un agente vulcanizante. Muchos metales y algunos cristales manifiestan también un comportamiento plástico, aunque más restringido, cuando se someten a la acción de elevadas presiones. Esto se atribuye a la creación de direcciones preferentes de deslizamiento por rotura o defectos cristalinos.
- Sustancias heterogéneas formadas por más de una fase que deben su plasticidad a la coexistencia de partículas sólidas y una fase líquida que actúa como lubricante y aglomerante de las primeras. Las propiedades plásticas de estos materiales desaparecen simplemente por secado. En este grupo se incluyen, entre otros, las pastas para modelado, la masilla de vidrieros y, sobre todo, las arcillas, cuyo comportamiento plástico, junto con su poder refractario, es la propiedad más importante que presentan.
El mecanismo de la plasticidad de las arcillas ha sido muy estudiado y discutido. En principio, se puede explicar porque una pasta de arcilla consta de multitud de partículas sólidas rodeadas por delgadas películas de agua que forman una cubierta viscosa. El espesor de la envoltura acuosa debe ser el suficiente para permitir a las partículas deslizarse entre sí cuando se someten a una fuerza de cizalladura. La fase líquida desempeña simultáneamente un doble papel; de un lado actúa como lubricante, facilitando el deslizamiento entre las partículas sólidas, y, de otro, al formar una tenue y elástica película envolvente, impide que aquéllas se separen demasiado. La plasticidad dependerá de la cohesión, y la cohesión de la afinidad entre las partículas de sólido y líquido. Como es sabido, los líquidos de naturaleza polar aumentan la plasticidad de las arcillas, porque ejercen una atracción más intensa sobre sus partículas. Las partículas de arcilla, debido a que presentan enlaces rotos y cargas eléctricas negativas sin neutralizar, cuando se suspenden en agua, se rodean de un manto acuoso en cuyo interior existen iones de diferentes cargas. Las cargas negativas, que muestra la partícula en su periferia, tienden a compensarse por un enjambre de cationes que están difusos por toda la película acuosa, cuyo espesor variará según el número, tamaño, carga y grado de hidratación de dichos cationes (fig. 3).
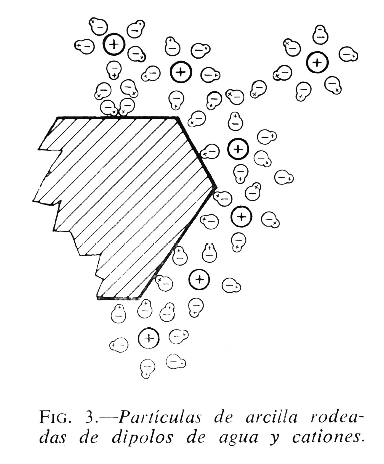
Del espesor de la película húmeda dependerá la separación entre las partículas de arcilla y, en consecuencia, su movilidad. Por eso, cuando el contenido de agua es relativamente elevado, la envoltura acuosa es más gruesa y puede haber flujo viscoso. Por el contrario, si la proporción de agua es baja, las partículas de arcilla se encuentran más próximas y aumenta la cohesión entre ellas.
La viscosidad de la fase líquida también influye sobre la cohesión entre las partículas. Los líquidos muy móviles, de baja viscosidad, no pueden utilizarse para preparar masas plásticas por ser poco adherentes las películas que forman. El agua, al tener una viscosidad moderada, se puede emplear satisfactoriamente.
Para poder comparar las propiedades plásticas de diferentes arcillas hay que considerar previamente una serie de factores que, de un modo u otro, ejercen una marcada influencia en la plasticidad.
Estos factores, estudiados por A. B. Searle y R. W. Grimshaw en su libro "The Chemistry and Physics of Clays", son:
- Contenido en agua.
- Tamaño de las partículas.
- Forma y estructura de las partículas.
- Agregación de las partículas.
- Superficie específica de las partículas.
- Orientación de las partículas.
- Adición de electrolitos y floculantes.
- Presencia de materia orgánica.
- Influencia del aire ocluido.
- Tratamiento térmico.
1.- Influencia del contenido en agua. La plasticidad de una arcilla está estrechamente relacionada con la formación de películas de agua alrededor de sus partículas, por lo que esta propiedad puede considerarse en principio como una función del contenido total de agua y de la superficie del conjunto de partículas que integran la masa de arcilla.
Norton, para explicar el mecanismo de la plasticidad, formuló su teoría de la membrana tensa. Considera que entre las partículas de una masa plástica de arcilla existen, por una parte, fuerzas repulsivas y por otra, la tensión superficial del agua que las rodea y que tiende a mantenerlas unidas formando un todo continuo. La máxima plasticidad se consigue, según Norton, cuando la proporción de agua es la justa para llenar la red de estrechos capilares que quedan entre las partículas individuales, formando una membrana tensa que las mantiene unidas. Para contenidos superiores de agua la tensión se relaja y disminuyen las fuerzas de unión. Por el contrario, si la cantidad de agua es muy pequeña, la envoltura que rodea a las partículas se rompe y la plasticidad desaparece.
La cantidad de agua que será preciso añadir a una arcilla para poderla moldear dependerá de la superficie real de sólido que se tenga y se comprende que, cuanto mayor sea su proporción de finos, así como también la cantidad de materia coloidal, más elevado será el volumen de agua que requiera. Este valor en la práctica no es absolutamente riguroso ya que todas las arcillas admiten agua entre unos límites en que su plasticidad se mantiene suficientemente elevada. Este margen, que se puede denominar intervalo de laborabilidad o de moldeabilidad, es variable de unas arcillas a otras, aunque se mantiene para las medianamente plásticas entre el 15-35 % de agua.
J. W. Mellor ha demostrado que la plasticidad de una arcilla se modifica por efecto de la presión a que se someta y de la deformación que sufra. Por esta razón la cantidad de agua que hay que añadir a una arcilla para que alcance una plasticidad determinada depende del método que se vaya a emplear para moldearla. En general se requerirá mayor proporción de agua cuanto menor sea la presión a que se trabaja. Así, una masa, para moldear ladrillos a mano debe ser más blanda y tener un contenido más elevado de humedad que cuando se utilice para prensarlos a máquina. Es éste un detalle aparentemente sin importancia, pero cuya omisión puede dar lugar a una producción defectuosa.
Mellor demostró experimentalmente que la plasticidad máxima de una cierta arcilla necesitaba para manifestarse proporciones crecientes de agua a medida que disminuía la presión:

2.- Influencia del tamaño de las partículas. Otra de las causas responsables de la plasticidad de las arcillas es la extremada finura de grano de estos minerales. Esta relación entre plasticidad y tamaño de grano, que ya fue establecida por Seger y posteriormente ha sido estudiada por otros autores, aparece en otros materiales distintos de la arcilla. Muchas sustancias no plásticas pueden manifestar una cierta plasticidad si se molturan hasta un grado de finura suficiente. Así, el cuarzo y la caliza, molidos y pasados a través de un tamiz de 200 mallas, cuando se mezclan con una pequeña cantidad de agua, resultan moderadamente plásticos. En otras sustancias como el cloruro cálcico, el sulfato de bario, el óxido de circonio, el feldespato, el vidrio molido, etc., aparecen propiedades similares. Sin embargo, las masas ligeramente plásticas a que dan lugar estas sustancias rara vez pueden moldearse con la misma facilidad que una pasta arcillosa. Además las formas obtenidas carecen de la cohesión necesaria y al secar se desmoronan.
3.- Influencia de la forma y estructura de las partículas. Uno de los factores que más unánimemente se han considerado como causa de la plasticidad de las arcillas es la forma laminar de sus partículas. Esto ha sido confirmado experimentalmente por algunos investigadores. Atterberg estudió una serie de sustancias finamente pulverizadas cuyas partículas eran laminares (BaSO4, BaCO3, SrCO3, CaF2, etc). Todas ellas podían moldearse fácilmente con un 20 a 25 % de agua. Otros minerales con un hábito cristalino más regular, como el cuarzo, feldespato, etcétera, no presentaban ninguna plasticidad, aún cuando se hubieran molido al mismo tamaño.
Le Chatelier consideró igualmente que la forma laminar de las partículas arcillosas condicionaba su plasticidad. Utilizó minerales de forma laminar, como glauconita, mica, pirofilita y talco que, bien pulverizados, le permitieron obtener masas plásticas. Para explicar el diferente comportamiento plástico de masas laminares y masas granulares, pone el ejemplo siguiente: Si sobre una mesa se echa una baraja de naipes, éstos conservan sus posiciones relativas ; en cambio, si lo que echamos sobre la mesa es un puñado de dados o de bolas, cada uno procede independientemente y todos ellos se disgregan.
Otra confirmación de la importancia de la forma laminar de las arcillas es que si se somete un caolín plástico a una molienda larga, lejos de mejorar su plasticidad, como pudiera pensarse a primera vista, se empeora, debido a que se destruye la estructura laminar de las partículas.
Aunque esta naturaleza laminar de las arcillas favorece grandemente sus propiedades plásticas, no quiere decirse con ello que sea la única forma bajo la cual pueda manifestarse. Las partículas fibrilares como las de atapulgita y haloisita dan lugar a masas también de elevada plasticidad. Tanto en el caso de arcillas laminares como fibrilares, la plasticidad está exaltada por la gran superficie específica que presentan, factor este que se considera más adelante.
4.- Influencia de la agregación de las partículas. La experiencia parece demostrar que la distribución de las partículas tiene un marcado efecto en la plasticidad de las arcillas. Se ha encontrado que las arcillas de grano muy fino y las de grano muy grueso son menos plásticas que las que contienen simultáneamente granos finos y gruesos. Según ha sugerido Mellor, esto se debe a que una distribución de granos de diferentes tamaños permite un empaquetamiento más cerrado y más compacto que proporciona una mayor plasticidad.
5.- Influencia de la superficie específica. En las arcillas, debido al pequeño tamaño de sus partículas y a la gran superficie que consecuentemente presentan, aparecen muy exaltados todos los fenómenos de superficie, como son las propiedades coloidales, la atracción intermolecular, etc., y, por tanto, su plasticidad viene también notablemente afectada por el valor de dicha superficie.
Para estudiar la influencia de la forma de las partículas en el valor de la superficie, eligen como ejemplos geométricos más representativos una esfera, un cubo, una lámina y un prisma de dimensiones comparables. Se ha tomado en todos los casos como dimensión mayor 2 R cm y como la menor XR cm, siendo X un factor de reducción inferior a la unidad. Suponiendo que la densidad es siempre la misma, se obtienen mediante un cálculo muy sencillo las expresiones generales consignadas en la figura 6.
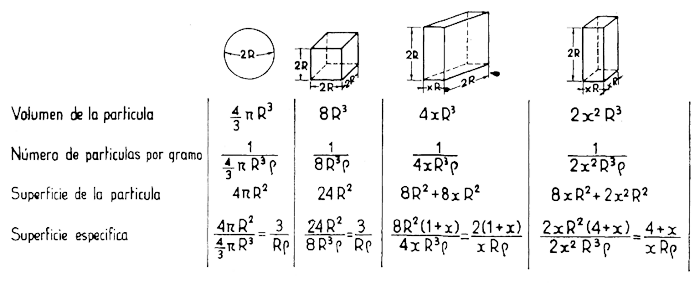
En el caso particular de que en los dos prismas considerados, el laminar y el acicular, la dimensión predominante guardase con la más pequeña la relación 1 : 10 (o sea R = 1 y X = 0,1), los valores de las superficies específicas de las cuatro figuras elegidas estarían en la proporción:
esfera : cubo : lámina : fibra : : 3 : 5 : 22 : 41.
Esto nos explica por qué las partículas laminares y aciculares presentan una plasticidad mucho mayor que las que tienen forma esférica o cúbica.
6.- Influencia de la orientación de las partículas. La forma frecuentemente laminar de las partículas de arcilla da lugar a efectos muy marcados de orientación que pueden modificar de modo apreciable la plasticidad de las pastas húmedas. Esta influencia puede ponerse de manifiesto orientando las partículas de una suspensión de arcilla, para lo cual bastará dejarlas sedimentar decantando después el exceso de agua y desecando en vacío. Las laminillas de arcilla se dispondrán en la masa acostadas unas sobre otras con su plano principal paralelo a la dirección de colocación.
Se comprende que, así dispuestas, la masa resultante ofrezca una mayor resistencia, o más elevado coeficiente de rigidez estática, cuando se aplique una fuerza vertical, o sea perpendicular a la dirección de colocación de las laminillas. En cambio, si la dirección de la fuerza aplicada fuese paralela a la dirección del lecho, el flujo se iniciaría para un valor de la presión mucho más bajo, lo que se explica porque las laminillas deslizan con facilidad unas sobre otras.
La plasticidad que normalmente presente una arcilla con sus partículas distribuidas al azar será intermedia entre la de los dos casos límites anteriores. Esta plasticidad inicial puede también modificarse por acción de la presión que tiene un efecto orientador sobre las partículas.
7.- Influencia de los electrolitos y floculantes. Hasta ahora sólo hemos comentado una serie de factores de naturaleza mecánica como causas modificadoras de la plasticidad. Sin embargo, tanta o más importancia que aquéllos tiene la presencia de sales solubles en una arcilla. Los iones procedentes de estas sales, al disolverse en agua y disociarse, alterarán el pequeño campo eléctrico creado por las partículas de arcilla cargadas y modificarán las fuerzas electrostáticas de atracción y repulsión entre las mismas. Además los iones adsorbidos en la periferia de las partículas arcillosas, también modificarán las distancias interlaminares. Todo esto, unido a que los electrolitos producen una variación en la tensión superficial de la fase líquida, repercute profundamente en la plasticidad.
La cantidad de agua requerida para producir una masa plástica es mayor en una arcilla ácida o cálcica que en una que tenga sodio como catión de cambio ; así, para un contenido determinado de agua, las arcillas ácidas o cálcicas necesitan mayores presiones para ser moldeadas, aunque el cuerpo en verde es más resistente y menos deformable que en las arcillas sódicas.
En general, el margen del contenido en agua dentro del cual la arcilla es moldeable es mayor en las arcillas sódicas que en las ácidas y cálcicas.
8.- Influencia de la materia orgánica. Los coloides orgánicos, como tanino, lignina, humus, etc., pueden estar presentes en la arcilla y afectar, por tanto, la plasticidad de la misma. Actúan como coloides protectores alrededor de las partículas arcillosas mejorando sus propiedades plásticas.
Para aumentar la plasticidad está muy difundido un método que consiste en dejar en reposo en estado húmedo las masas trabajadas y desgrasadas, durante algunas semanas o meses antes de efectuar su moldeo.
La flora microbiana de los suelos y de las aguas naturales puede desarrollarse también en las arcillas y a sus procesos fermentativos se debe indirectamente un incremento de las propiedades plásticas de las mismas. Conocido de antiguo este hecho, aunque ignorado su verdadero mecanismo, siempre ha sido una práctica común desde la época brillante de la cerámica oriental, la de dejar en reposo en pudrideros, durante varios años, las arcillas sometidas a un proceso de maduración. La eficacia de esta lenta espera se ha podido comprobar comparando la plasticidad desarrollada en una arcilla natural con la de una arcilla esterilizada. En general, cualquier adición que se haga a las arcillas durante ese largo proceso para activar la acción bacteriana, redundará en beneficio de la plasticidad. El ácido tánico mejora la resistencia a la rotura, aunque reduce el margen de plasticidad. La acción de la maduración depende de los tipos de arcilla ; así, mientras la plasticidad de las pastas con caolín de Zettlitz sólo aumenta en un 50 %, en algunas arcillas se consigue mejorar hasta en un 200 %.
9.- Influencia del aire ocluido. El aire ocluido en la masa de arcilla, que ya desempeñó un papel importante, primero como agente químico oxidante, durante los largos procesos de meteorización y formación de la arcilla y después, a lo largo de su estancia en el pudridero, favoreciendo y manteniendo el desarrollo de la flora bacteriana vuelve a manifestar su influencia a la hora de trabajar y moldear la arcilla. Su presencia, que entonces fue favorable, ahora resulta perjudicial para la plasticidad, ya que las pequeñas oclusiones gaseosas disminuyen la cohesión de las partículas. Este aire y el que además se introducirá mecánicamente durante la preparación de la pasta, se convertirá a menudo en un molesto enemigo para el ceramista, formando burbujas y ampollas en el material y siendo causa frecuente de laminaciones y deformaciones. Lo mejor para eliminar este aire es hacer pasar la pasta por una amasadora de vacío.
10.- Influencia de la temperatura. El tratamiento térmico previo a que se haya podido someter una arcilla es otra causa modificadora de su plasticidad. A medida que se deja evaporar el agua que humedece una masa, plástica en su grado máximo, el valor de la plasticidad va decreciendo hasta anularse cuando está completamente seca. Si se vuelve a humedecer la arcilla, recupera su plasticidad de una manera reversible. En general la plasticidad se pierde total y definitivamente cuando la arcilla se calienta entre 500° y 750°C, lo que coincide, según ha demostrado Salmang y Rittgen, con la alteración de la estructura reticular de la arcilla.
El secado de la arcilla
La arcilla es un material de poco o ningún valor práctico hasta que no se cuece y hace duradera. El adobe, o ladrillo secado al Sol, es una excepción, pero nadie sostendría que un adobe en sí sea superior a un ladrillo cocido. Estamos interesados en la arcilla no por lo que es en estado natural sino por aquello en que puede convertirse.

Cuando la arcilla plástica se seca contrae alrededor de un 5%. Algunas arcillas muy plásticas llegan a contraerse hasta un 8% o más.
Cuando la arcilla seca se humedece absorbe una cantidad sorprendente de agua. Para hacerse suficientemente plástica para modelarse, una arcilla promedio necesitará unas 30 partes de agua en peso por cada 100 partes de arcilla.
El secado de la arcilla se produce a una velocidad controlada por la humedad de la atmósfera que la rodea. Cuando la humedad es del 100% nada se seca. Pero si la humedad del aire que la rodea es menor del 100%, el agua abandona la arcilla como vapor. Cuando la superficie de la masa de arcilla está ligeramente seca, sale afuera más agua del interior de la masa por atracción capilar.
¿Qué es la humedad del aire?
A unas condiciones dadas de presión y temperatura, corresponde una concentración máxima de vapor de agua en el aire sin que se produzca condensación. Cuando decimos que hay una humedad del 50%, por ejemplo, queremos decir que la concentración de vapor de agua en el aire es la mitad de la concentración máxima sin que haya condensación.

A medida que la película entre las partículas de agua se pierde por evaporación, las partículas se acercan más entre si cerrando el espacio que había sido ocupado por el agua. El efecto acumulativo de cada partícula acercándose a su vecina es la contracción de toda la masa. La cantidad de esta contracción de secado dependerá del tamaño de las partículas de arcilla y de la cantidad de agua que las separaba. Las arcillas que tienen un tamaño de partículas muy fino se contraen más.
La contracción y el secado están casi siempre relacionados con la estructura del grano de la arcilla y, por ello, también con la plasticidad.
Cuando el agua se ha evaporado de entre las partículas y todas las partículas están en contacto, la contracción de secado se termina. En esta etapa, que suele llamarse estado de cuero duro, las partículas de arcilla en sí mismas todavía pueden contener agua que no se eliminará hasta alcanzar la temperatura de ebullición, sin embargo, ya no se producirá más contracción por secado.
Para evitar el alabeo, el agrietamiento o la deformación, los objetos hechos de arcilla plástica deben secarse lenta y uniformemente. Si una parte del objeto de arcilla se seca más rápidamente que otra, la contracción desigual entre las dos partes puede causar alabeo o agrietamiento. Un ejemplo familiar es la baldosa que se curva hacia arriba cuando se seca; la cara de la baldosa que está expuesta al aire se contrae más rápidamente que la de abajo.
La chamota es arcilla que ya se ha cocido anteriormente y luego se ha molido a un tamaño de partículas más o menos fino. Tal material, habiendo sido ya secado y cocido, no sufre contracción posterior y la adición de chamota a la pasta de arcilla disminuye la contracción total. Su uso es común cuando los objetos deben hacerse con paredes o secciones gruesas.
Las pastas de arcilla secas varían grandemente en resistencia en seco. Un objeto hecho de arcilla plástica puede ser 6 o 7 veces más fuerte que otro hecho de caolín. La propiedad de resistencia en seco está directamente relacionada con el tamaño de partículas y, en consecuencia, con la plasticidad. Cuanto más plástica sea una arcilla, más resistencia desarrollará en estado seco.
A continuación, se presenta la hoja de características del barro rojo de baja temperatura utilizado en la escuela (referencia PF*E). En la hoja de características aparecen una serie de datos interesantes como el agua de plasticidad, la composición química, la contracción en el secado, la contracción en la cocción a una temperatura dada, etc.

Bibliografía
- Arcilla y vidriado para el ceramista, Daniel Rhodes. Editorial CEAC, 1990
- Mineralogía de arcillas de suelos, Eduardo Besoain. Instituto Americano de Cooperación para la Agricultura, 1985
- Arcillas cerámicas: una revisión de sus distintos tipos, significados y aplicaciones, L.A. Díaz Rodríguez y R. Torrecillas. Boletín Soc. Esp. Cerám. Vidrio nº41-5 (2002)
- Origen y composición de las arcillas cerámicas, A. García verduch, 1985
- Materias primas cerámicas. Yacimientos de arcillas y caolines, C. Guillem Monzonis y Mª C. Guillem Villar. Boletín Soc. Esp. Cerám. Vidrio nº27-4 (1988)
- Cerámica Industrial, Singer y Singer. Editorial Urmo, 1976
- Plasticidad de las arcillas, J.M. Fernández Navarro. Boletín Soc. Esp. Cerám. Vidrio nº1-7 (1962)
- The Potter's Dictionary, F. y J. Hamer. Fifth edition, A&C Black y University of Pennsylvania Press, 2012
- Science for potters, Linda Bloomfield. The American Ceramic Society, 2017
- Tecnología de los Materiales Cerámicos, Juan Morales Güeto. Editorial Diaz de Santos, 2005